Слайд 2Строение атома углерода
Аr = 12
+6С (6 р; 6 n)6е
1S2 2S2

2P2
2S1 2P3
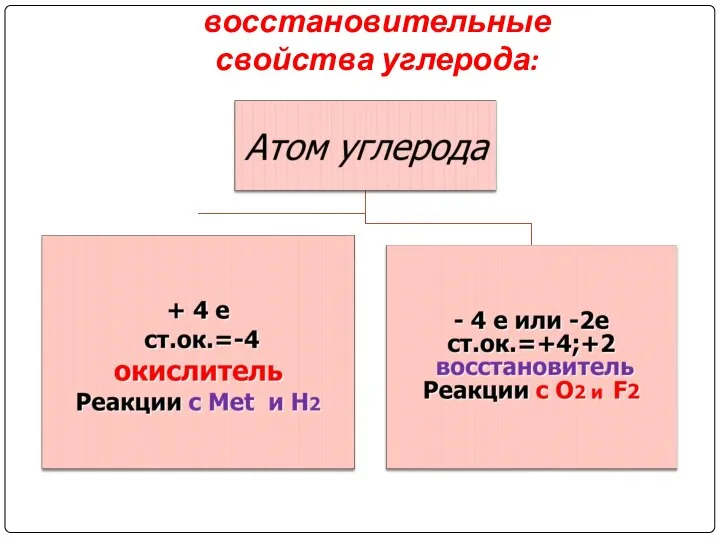
Степени окисления: -4, 0, +2, +4
Слайд 3
Окислительно-восстановительные
свойства углерода:
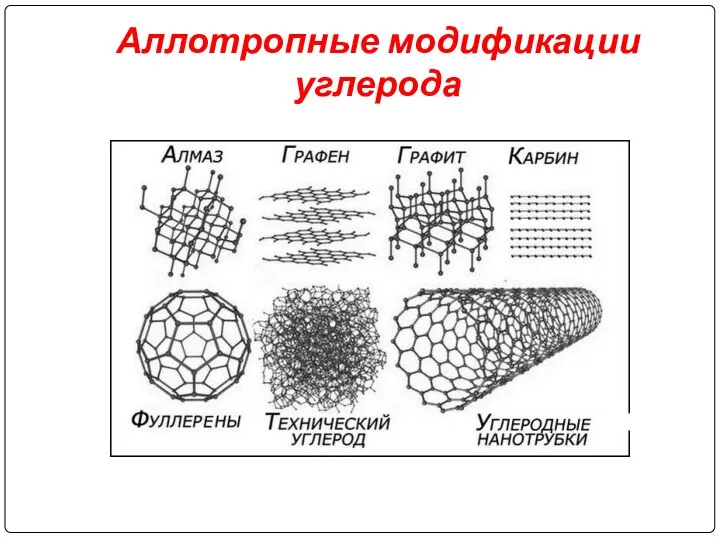
Слайд 4Аллотропные модификации углерода
Слайд 5Алмаз
Прозрачный (изредка окрашен)
Очень твердый
Преломляет свет (светится)
Не проводит ток
Плохо проводит тепло
Атомная кристаллическая решетка
При

10000С без доступа воздуха превращается в графит
Слайд 6
Искусственно ограненные алмазы называются бриллиантами

Слайд 7 Вес алмаза измеряется в каратах, сокращение ct.
Само слово «карат» происходит от

названия семян караибского дерева, которые служили в древности природной мерой веса алмазов.
Один карат соответствует 0,2 г.
Слайд 8Держава
и
Большой бриллиантовый букет

Слайд 9Колумбийский изумруд
и
Цейлонский сапфир

Слайд 13Графит
Темно - серое слоистое кристаллическое вещество
Слабый металлический блеск
Мягкий
Проводит электрический ток
Жирное на ощупь
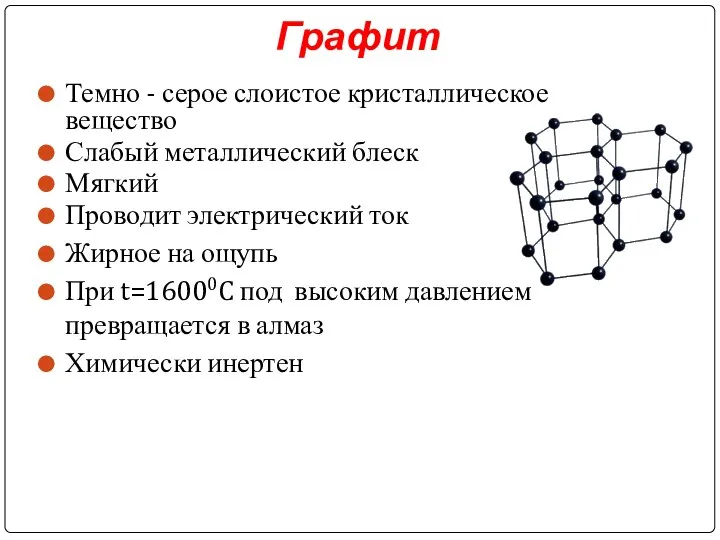
При t=16000C под высоким давлением превращается в алмаз
Химически инертен
Слайд 14Карбин
Мелкокристаллический порошок, черного цвета
Состоит из прямолинейных цепочек углеродных атомов
Полупроводник
При нагревании до высоких

температур без доступа воздуха превращается в графит
Слайд 15Фуллерены
Замкнутая сферическая структура
Образованна из определённого числа атомов углерода - С60, С70, С84

Молекула фуллерена представляет собой шар, поверхность которого состоит из пяти – и шестичленных циклов
Впервые фуллерены были синтезированы в 80-х годах XX века.
Слайд 16
Аморфный углерод
не является аллотропным видоизменением углерода, а представляет собой мелкокристаллический

графит.
Сортами этого углерода являются
древесный уголь,
кокс сажа
стеклоуглерод
Слайд 17
Адсорбция
явление адсорбции было открыто русским химиком ЛОВИЦЕМ

Слайд 18Адсорбция – свойства угля и других твердых веществ поглощать и удерживать на

своей поверхности газообразных или растворенных веществ
Адсорбенты – вещества , на поверхности которых происходит адсорбция
Десорбция - обратный адсорбции процесс -выделение поглощенных веществ
Слайд 19Н.Д.Зелинский
на основе адсорбционных свойств
древесного угля разработал
фильтрующий противогаз
Николай Дмитриевич Зелинский

(1861-1953)
профессор Московского Университета, академик
Слайд 20Химические свойства углерода
Углерод – окислитель:
Реакции с простыми веществами
C + 4Na →

Na4C
2C + Ca → CaC2
3C + 4Al → Al4C3
C + 2H2 → CH4
Слайд 21Химические свойства углерода
Углерод – восстановитель:
Реакции с простыми веществами
C + O2 →

CO2
2 C + O2 → 2CO
C + 2 Cl2 → CCl4
C + 2 S→ CS2
Реакции со сложными веществами
C + H2O → CO + H2↑
C + 2 CuO → 2 Cu + CO2
C + 4 HNO3 конц. → CO2 + 4 NO2 + 2 H2O
C + 2 H2SO4 конц. → CO2 + 2 SO2 + 2 H2O




















 Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Циклические эфиры (окиси)
Циклические эфиры (окиси) Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Химическая кинетика и равновесие
Химическая кинетика и равновесие Углеводороды. Общие знания
Углеводороды. Общие знания Формула любви
Формула любви Строение органических соединений
Строение органических соединений Типичные реакции кислот
Типичные реакции кислот Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Химические элементы
Химические элементы Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку
Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии Художественная обработка металла
Художественная обработка металла Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Природные источники углеводородов
Природные источники углеводородов Стереоизомерия
Стереоизомерия Почему амины считают органическими основаниями?
Почему амины считают органическими основаниями? Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Презентация на тему Коллоидная химия
Презентация на тему Коллоидная химия  Презентация на тему Звездный час (9 класс)
Презентация на тему Звездный час (9 класс)  День химии
День химии Основные понятия и законы химии
Основные понятия и законы химии Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Гетерогенные дисперсные системы
Гетерогенные дисперсные системы Строение вещества
Строение вещества Причины протекания химических реакций
Причины протекания химических реакций Железо и его соединения
Железо и его соединения