Содержание
- 2. Предмет біоорганічної хімії Біоорганічна хімія – це наука, яка вивчає будову, фізико-хімічні властивості біологічно активних сполук,
- 3. Предмет біоорганічної хімії Клітина живого організму - дуже складний мікроскопічний реактор Хімік-органік + біохімік + молекулярний
- 4. Предмет біоорганічної хімії Ознайомлення людства з органічними сполуками почалося в стародавніх Єгипті, Індії, Фінікії. Застосовуючи досить
- 5. Предмет біоорганічної хімії В «алхімічний період» (IV – XVIст.), не знаючи складу органічних речовин, алхіміки провели
- 6. Предмет біоорганічної хімії Органічна хімія - наука, що вивчає сполуки карбону (вуглецю) з іншими елементами. Найчастіше
- 7. Предмет біоорганічної хімії Надзвичайно важливе значення для розвитку органічної хімії мав синтез сечовини (речовини тваринного походження),
- 8. Теорія хімічної будови органічних сполук О.М.Бутлерова 1. Атоми в молекулах органічних речовин сполучені між собою в
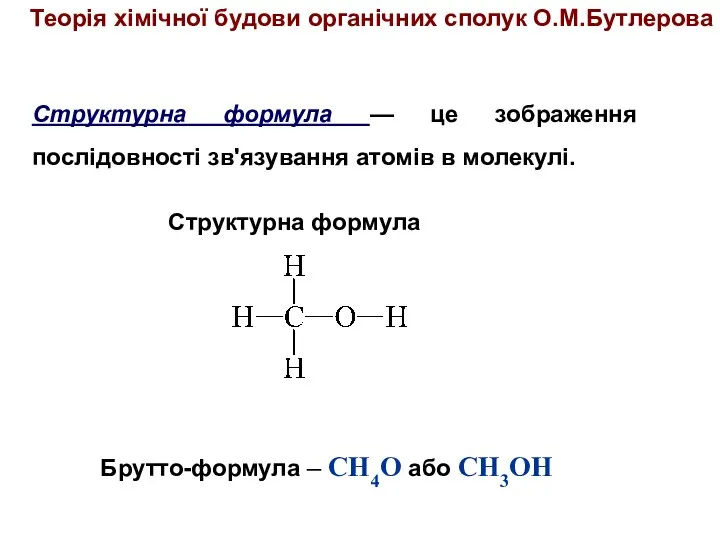
- 9. Структурна формула — це зображення послідовності зв'язування атомів в молекулі. Брутто-формула – СН4О або CH3OH Структурна
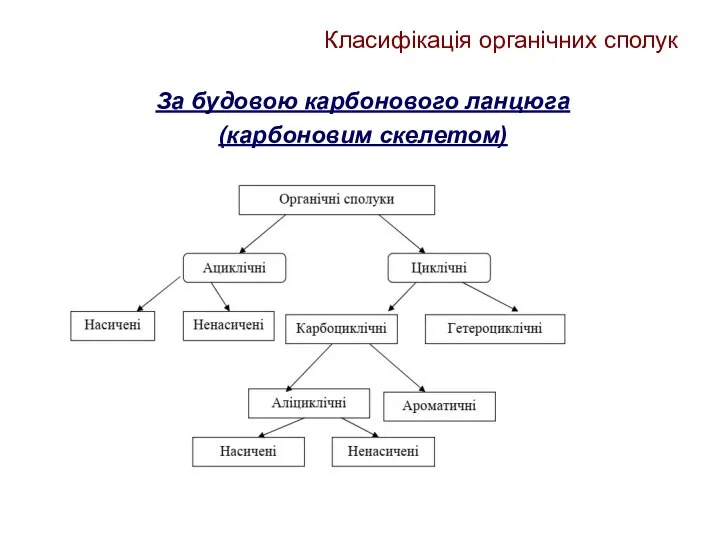
- 10. Класифікація органічних сполук За будовою карбонового ланцюга (карбоновим скелетом)
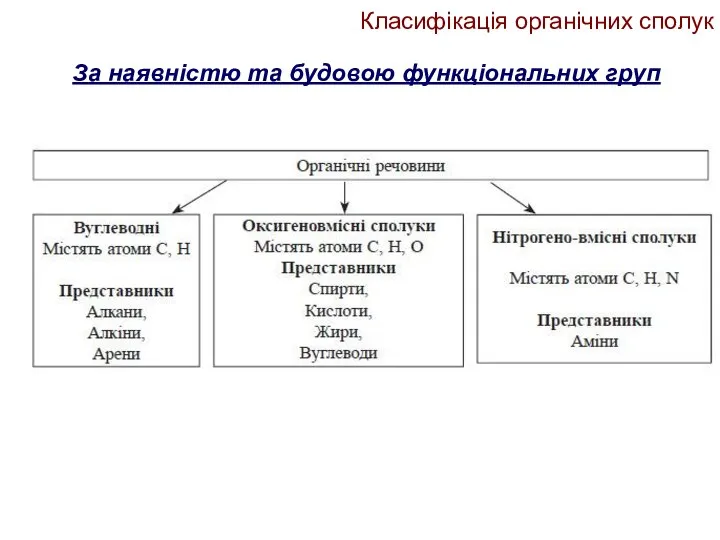
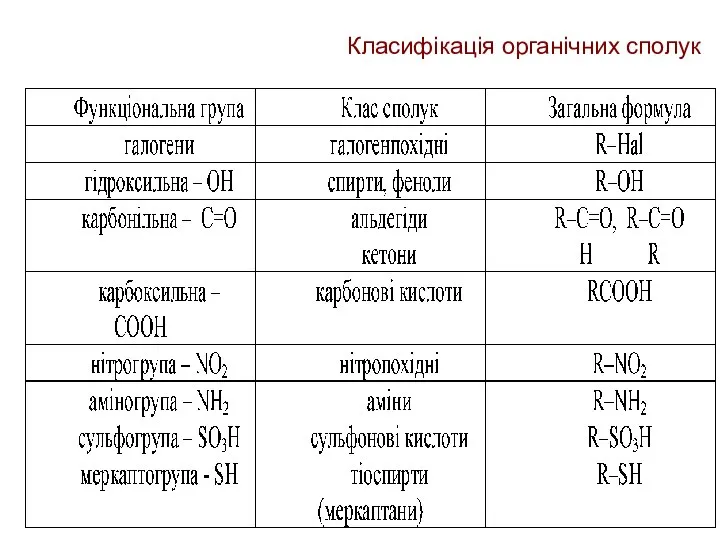
- 11. Класифікація органічних сполук За наявністю та будовою функціональних груп
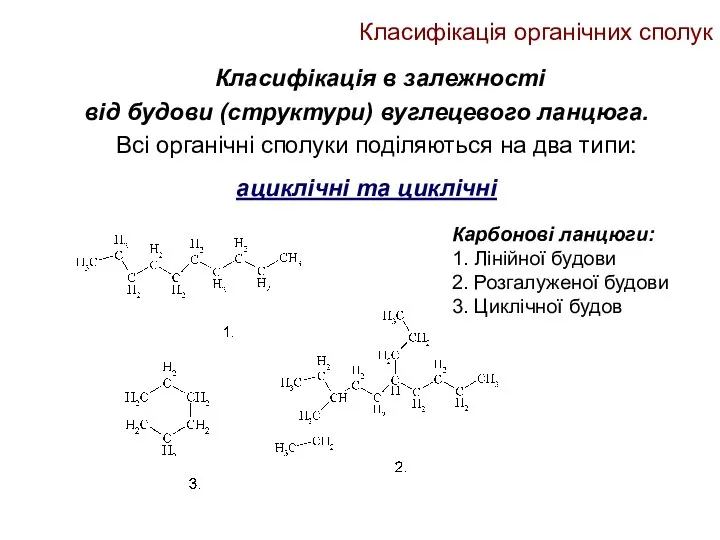
- 12. Класифікація органічних сполук Класифікація в залежності від будови (структури) вуглецевого ланцюга. Всі органічні сполуки поділяються на
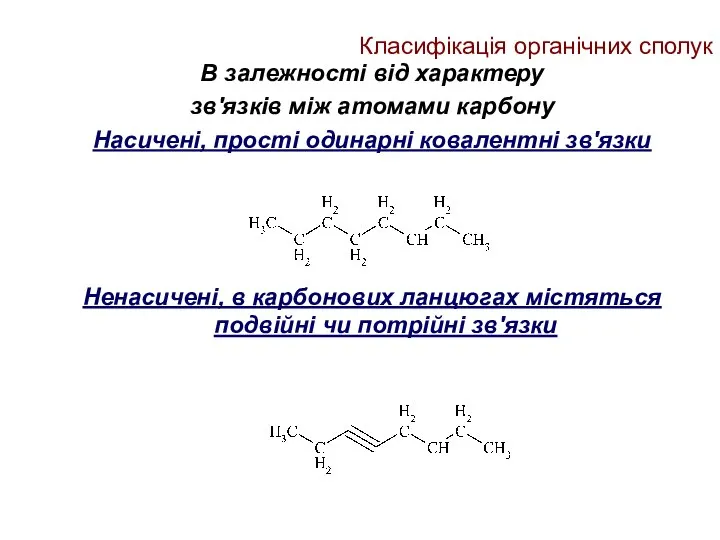
- 13. Класифікація органічних сполук В залежності від характеру зв'язків між атомами карбону Насичені, прості одинарні ковалентні зв'язки
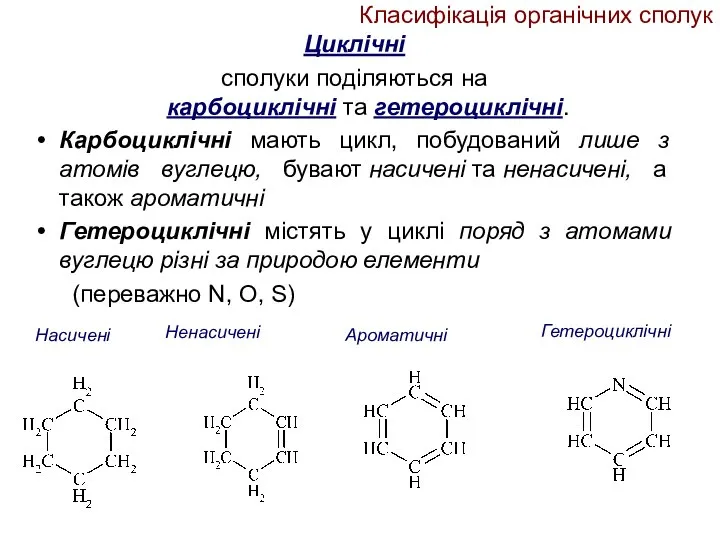
- 14. Класифікація органічних сполук Циклічні сполуки поділяються на карбоциклічні та гетероциклічні. Карбоциклічні мають цикл, побудований лише з
- 15. Класифікація органічних сполук Функціональна група - це група атомів чи окремий атом, що має невуглеводневу природу
- 16. Класифікація органічних сполук
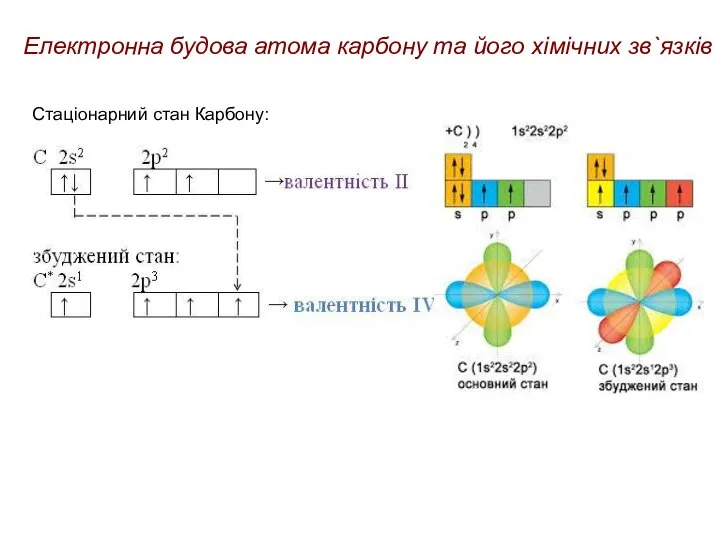
- 17. Електронна будова атома карбону та його хімічних зв`язків Молекули органічних сполук побудовані з атомів, які як
- 18. Електронна будова атома карбону та його хімічних зв`язків Стаціонарний стан Карбону:
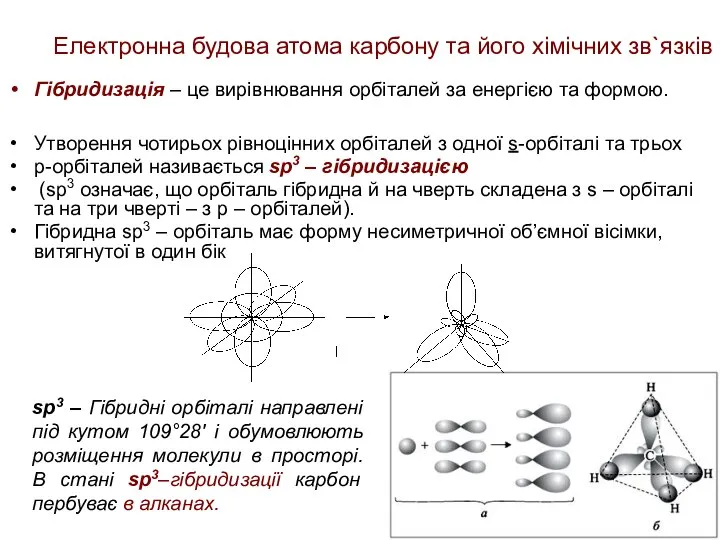
- 19. Електронна будова атома карбону та його хімічних зв`язків Гібридизація – це вирівнювання орбіталей за енергією та
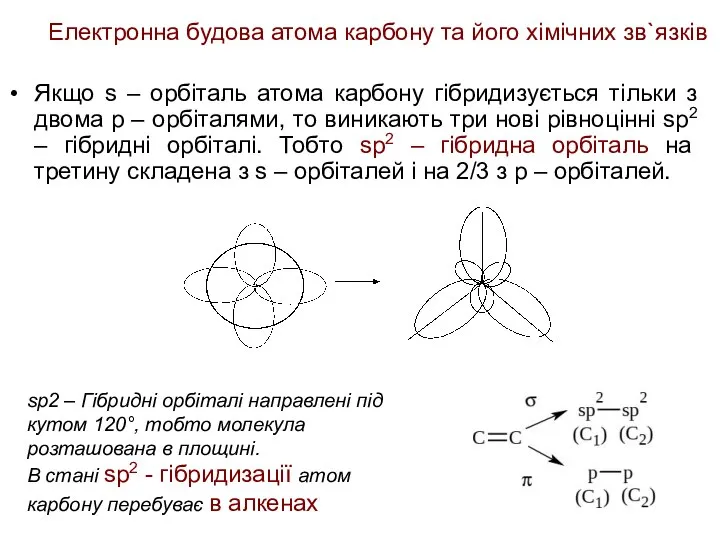
- 20. Електронна будова атома карбону та його хімічних зв`язків Якщо s – орбіталь атома карбону гібридизується тільки
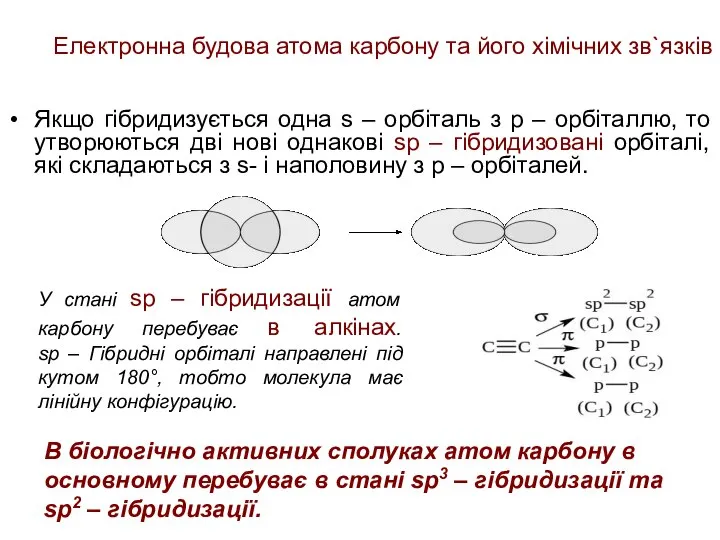
- 21. Електронна будова атома карбону та його хімічних зв`язків Якщо гібридизується одна s – орбіталь з р
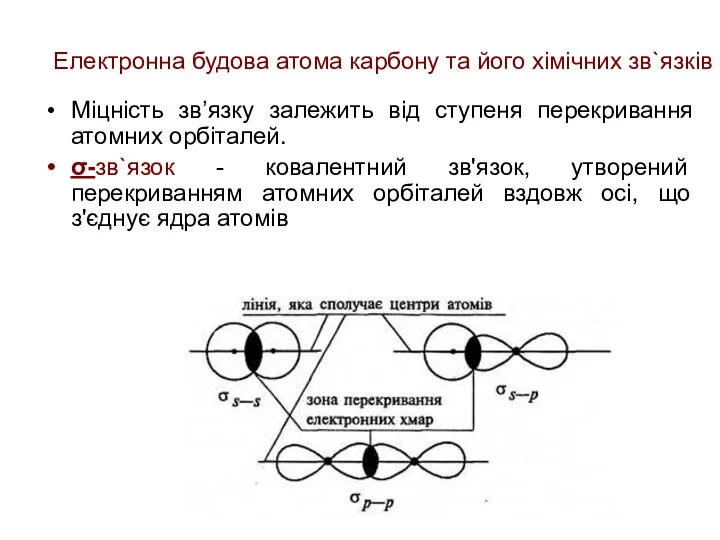
- 22. Електронна будова атома карбону та його хімічних зв`язків Міцність зв’язку залежить від ступеня перекривання атомних орбіталей.
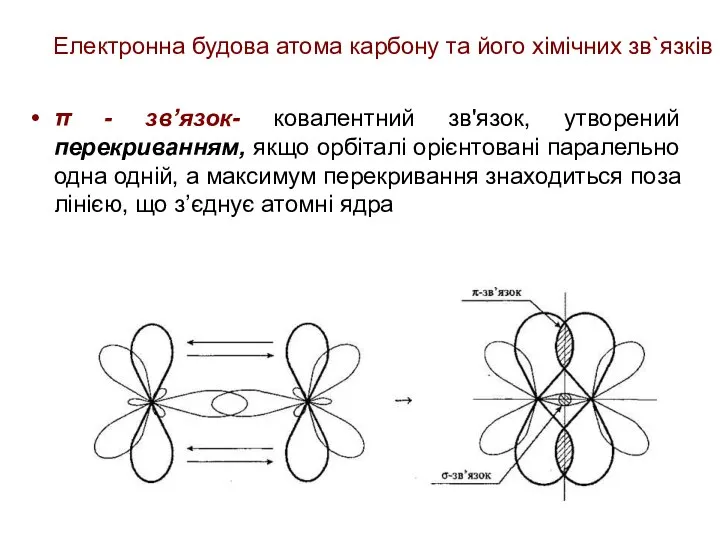
- 23. Електронна будова атома карбону та його хімічних зв`язків π - зв’язок- ковалентний зв'язок, утворений перекриванням, якщо
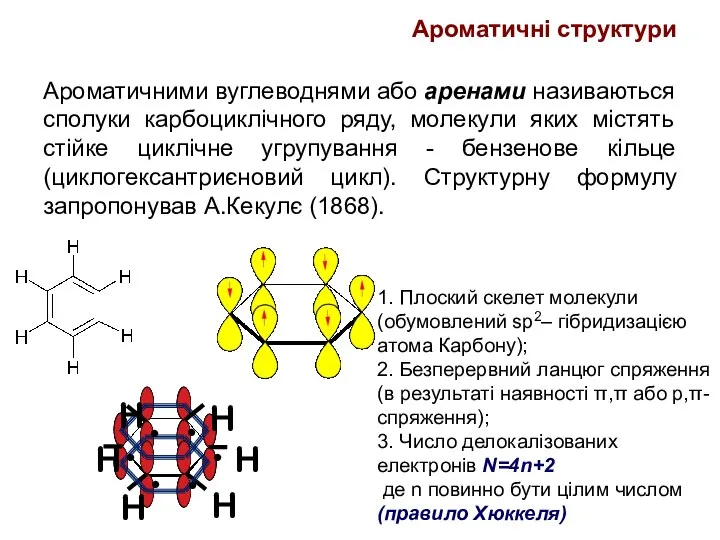
- 24. Ароматичними вуглеводнями або аренами називаються сполуки карбоциклічного ряду, молекули яких містять стійке циклічне угрупування - бензенове
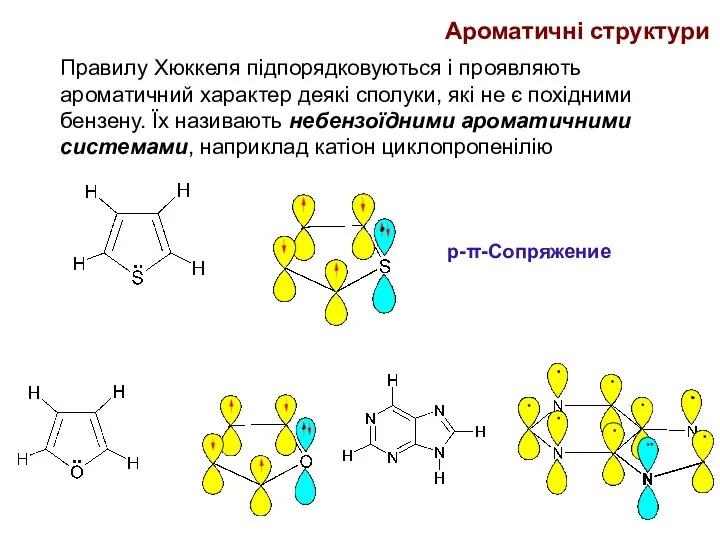
- 25. Правилу Хюккеля підпорядковуються і проявляють ароматичний характер деякі сполуки, які не є похідними бензену. Їх називають
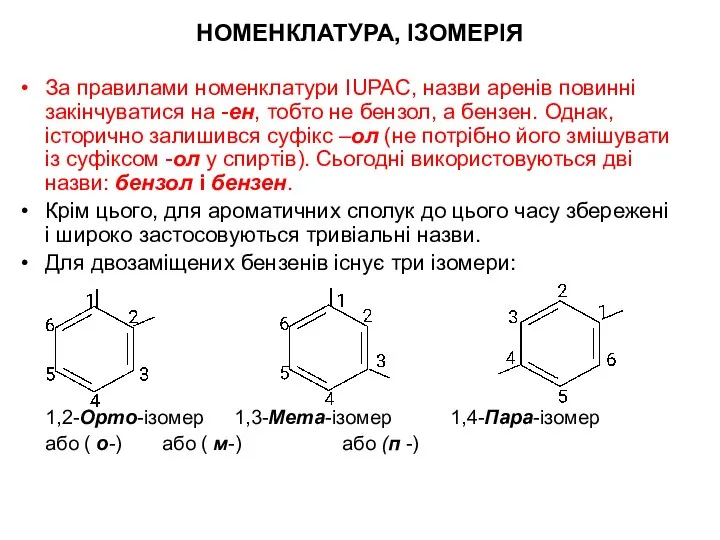
- 26. НОМЕНКЛАТУРА, ІЗОМЕРІЯ За правилами номенклатури IUPAC, назви аренів повинні закінчуватися на -ен, тобто не бензол, а
- 27. Електронні ефекти органічних сполук Індуктивний ефект ( I ) - це зсув електронної густини до електронегативнішого
- 28. Електронні ефекти органічних сполук Мезомерний ефект (М) або ефект супряження - зсув електронної густини по супряженій
- 29. Взаємний вплив атомів в молекулі Індуктивний ефект Зміщення електронної густини по лінії σ- зв'язків називається індуктивним
- 30. Взаємний вплив атомів в молекулі Індуктивний ефект Електроноакцепторні замісники – це атом або група атомів, що
- 31. Взаємний вплив атомів в молекулі Індуктивний ефект 1. Индуктивный эффект проявляется всегда при наличии в молекуле
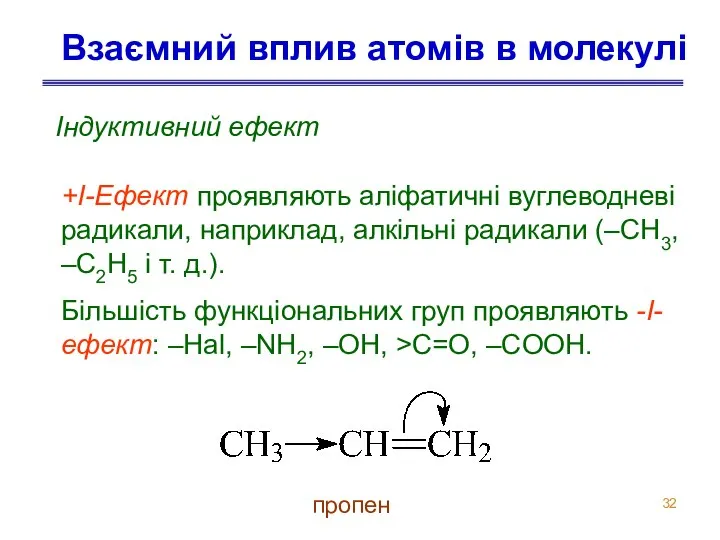
- 32. Взаємний вплив атомів в молекулі Індуктивний ефект +I-Ефект проявляють аліфатичні вуглеводневі радикали, наприклад, алкільні радикали (–CH3,
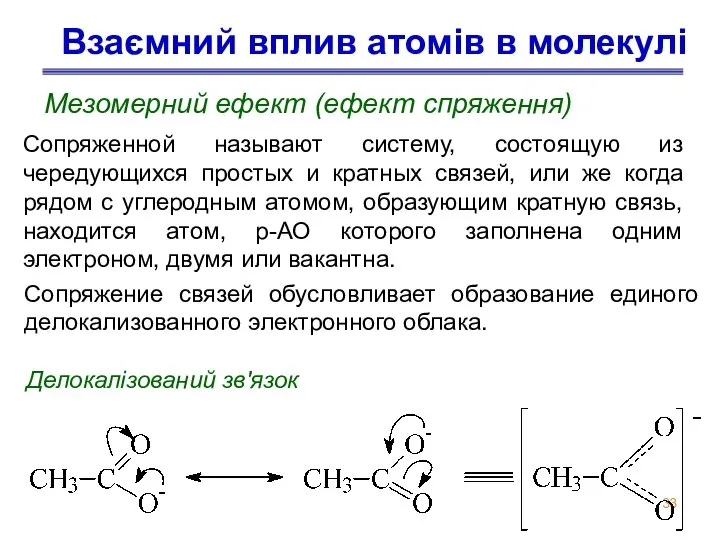
- 33. Взаємний вплив атомів в молекулі Мезомерний ефект (ефект спряження) Делокалізований зв'язок Сопряженной называют систему, состоящую из
- 34. Гомологи Групи органічних сполук однотипної структури з однаковими функціональними групами, що відрізняються один від одного на
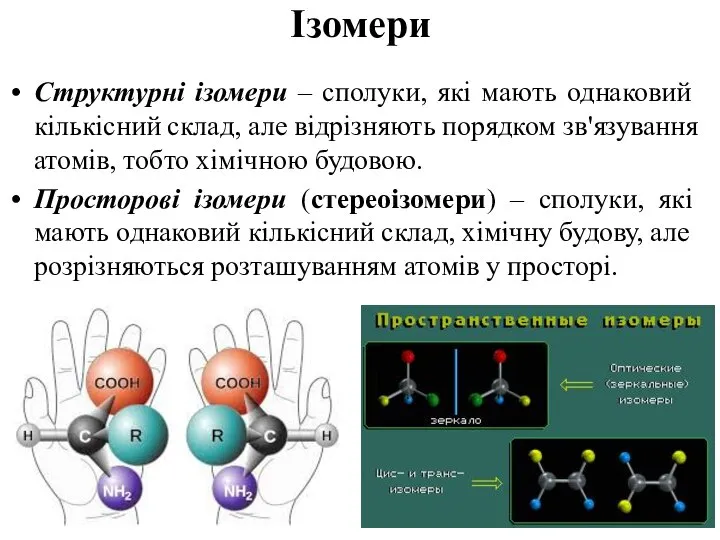
- 35. Ізомерія Ізомерія – це існування органічних сполук із однаковим якісним та кількісним складом, але різними властивостями,
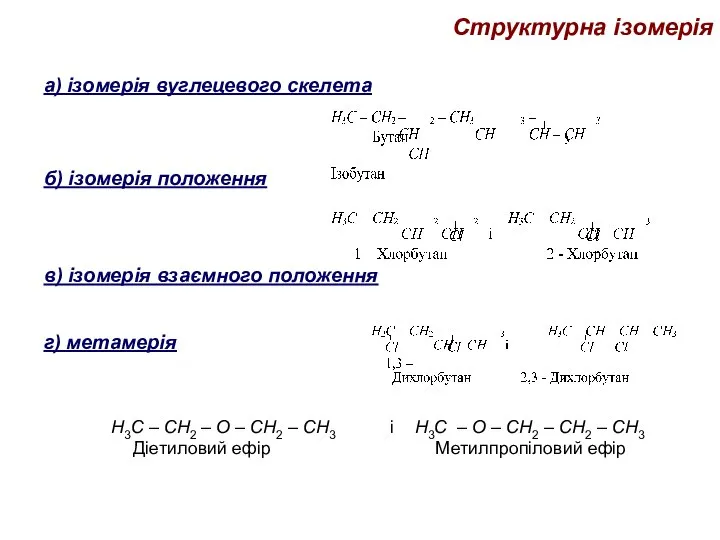
- 36. Структурна ізомерія а) ізомерія вуглецевого скелета б) ізомерія положення в) ізомерія взаємного положення г) метамерія Н3С
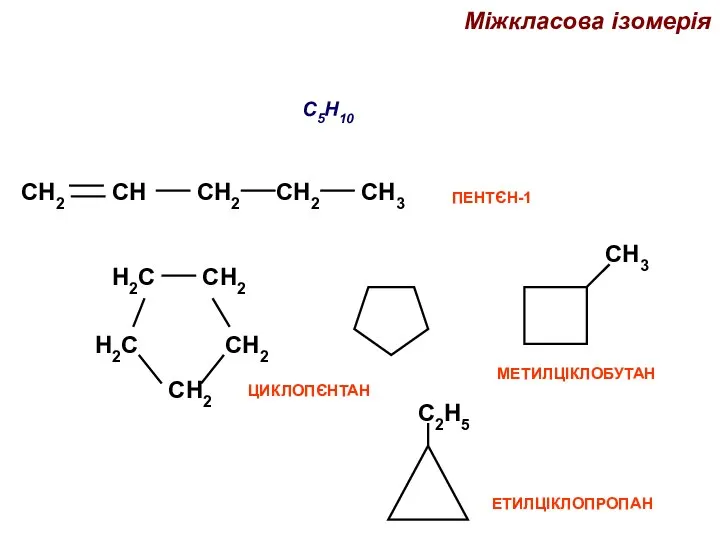
- 37. Міжкласова ізомерія C5H10 ЕТИЛЦІКЛОПРОПАН
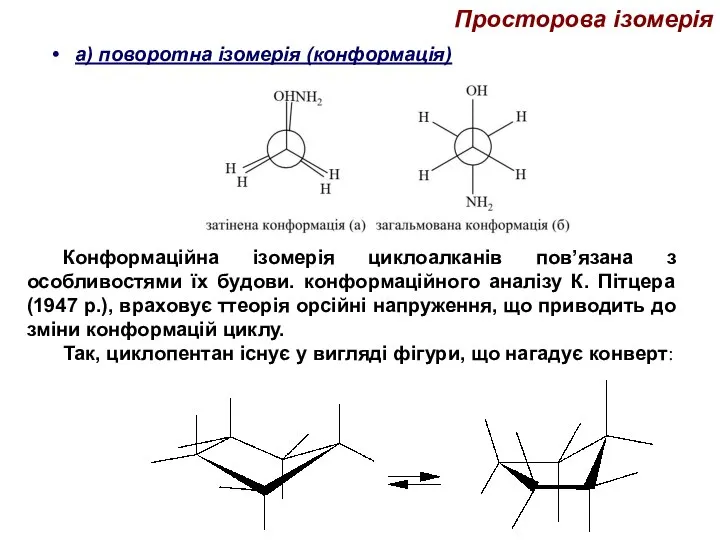
- 38. Просторова ізомерія а) поворотна ізомерія (конформація) Конформаційна ізомерія циклоалканів пов’язана з особливостями їх будови. конформаційного аналізу
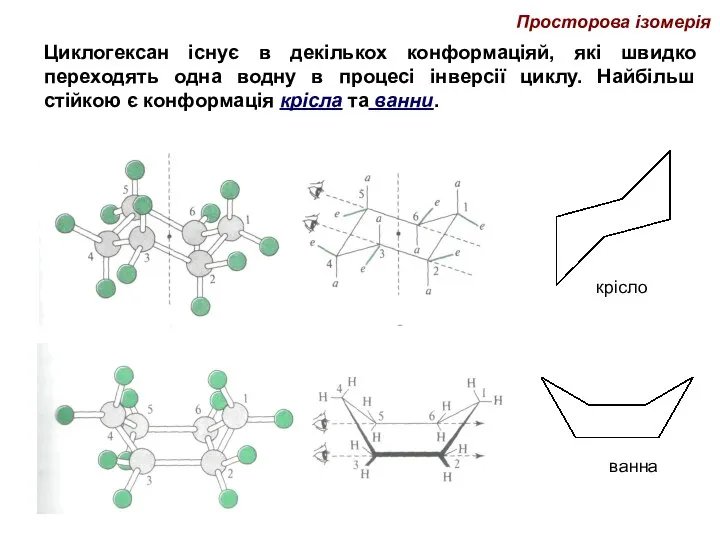
- 39. Просторова ізомерія Циклогексан існує в декількох конформаціяй, які швидко переходять одна водну в процесі інверсії циклу.
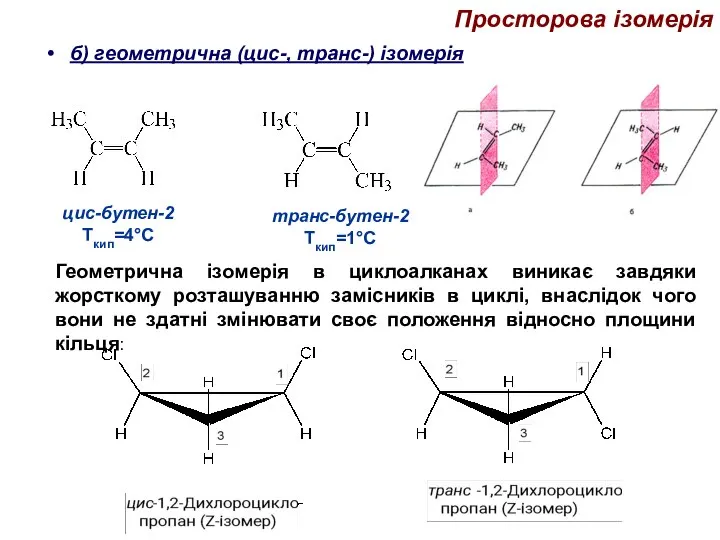
- 40. б) геометрична (цис-, транс-) ізомерія Просторова ізомерія Геометрична ізомерія в циклоалканах виникає завдяки жорсткому розташуванню замісників
- 41. Просторова ізомерія в) оптична (дзеркальна) ізомерія Енантіомерія – вид ізомерії обумовлений здатністю речовин обертати площину поляризації.
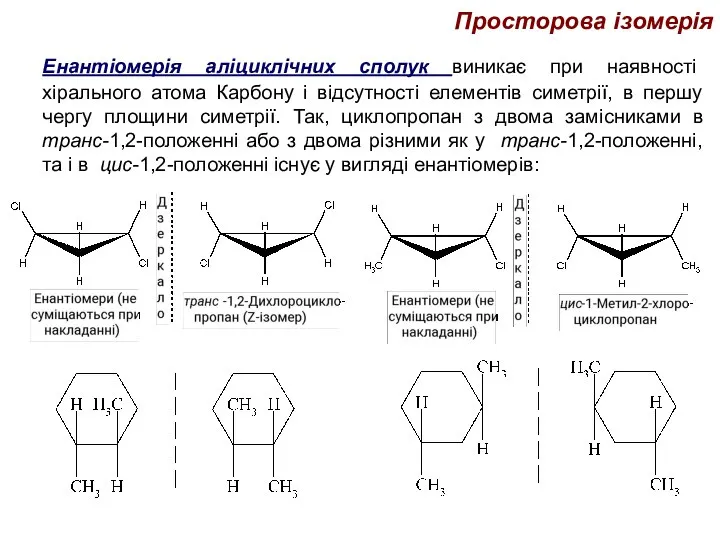
- 42. Просторова ізомерія Енантіомерія аліциклічних сполук виникає при наявності хірального атома Карбону і відсутності елементів симетрії, в
- 43. Ізомери Структурні ізомери – сполуки, які мають однаковий кількісний склад, але відрізняють порядком зв'язування атомів, тобто
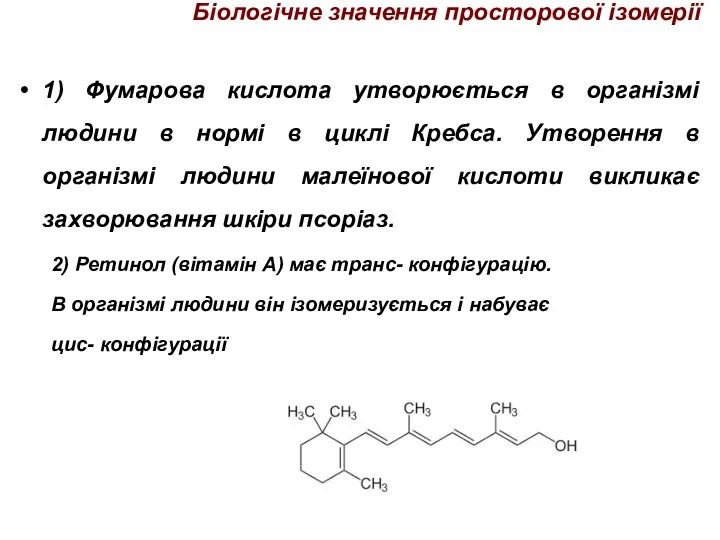
- 44. Біологічне значення просторової ізомерії 1) Фумарова кислота утворюється в організмі людини в нормі в циклі Кребса.
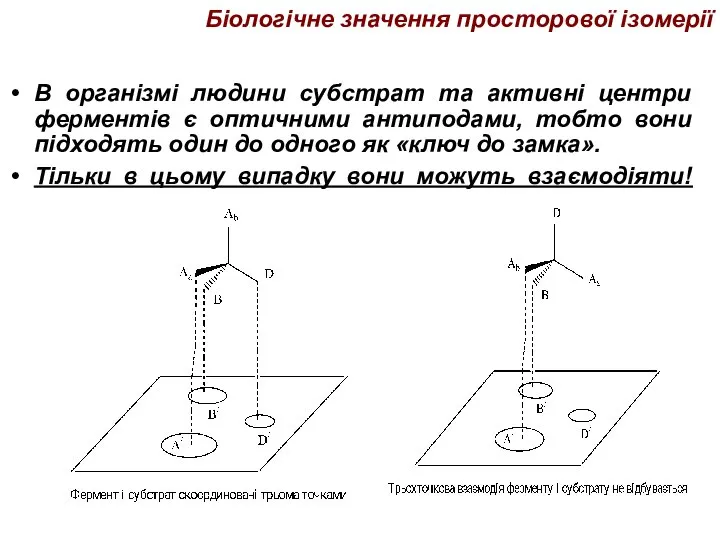
- 45. Біологічне значення просторової ізомерії В організмі людини субстрат та активні центри ферментів є оптичними антиподами, тобто
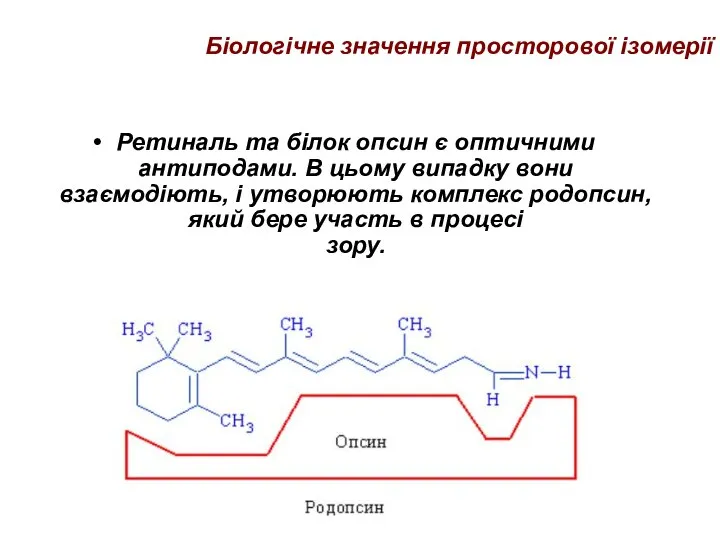
- 46. Біологічне значення просторової ізомерії Ретиналь та білок опсин є оптичними антиподами. В цьому випадку вони взаємодіють,
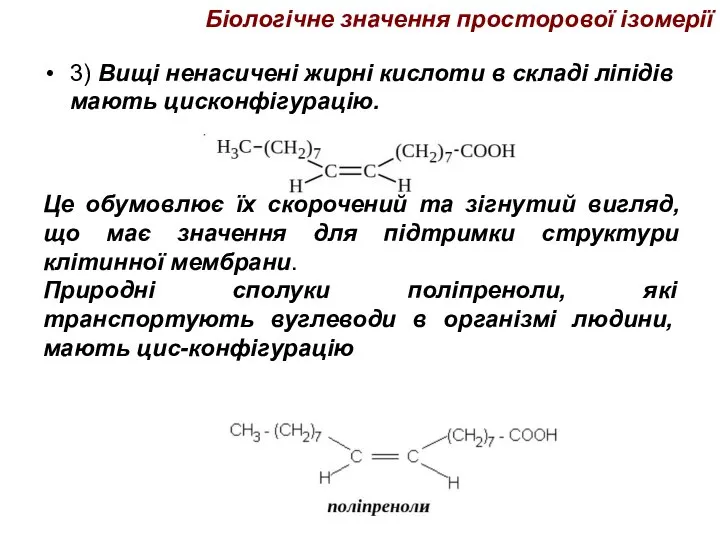
- 47. Біологічне значення просторової ізомерії 3) Вищі ненасичені жирні кислоти в складі ліпідів мають цисконфігурацію. Це обумовлює
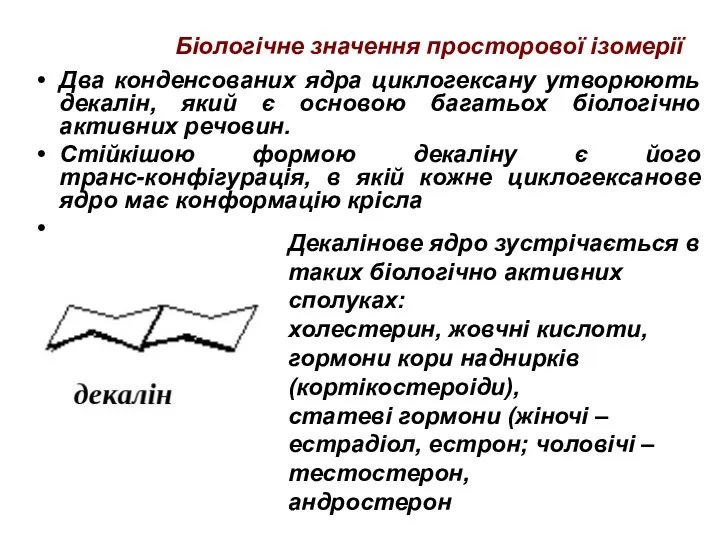
- 48. Біологічне значення просторової ізомерії Два конденсованих ядра циклогексану утворюють декалін, який є основою багатьох біологічно активних
- 49. Типи хімічних реакцій Реакційний центр - атом або група атомів, які беруть участь в утворенні хімічного
- 50. Класифікація органічних реакцій Класифікація органічних реакцій за типами хімічних перетворень зв'язків Реакції дисоціації та рекомбінації А-В
- 51. Номенклатура органічних сполук Основними типами сучасної номенклатури органічних сполук є: тривіальна, раціональна та міжнародна (IUPAC). Тривіальна
- 52. Номенклатура органічних сполук Раціональна номенклатура Головний принцип раціональної номенклатури полягає в тому, що будь який член
- 53. Міжнародна номенклатура (IUPAC). Правила сучасної номенклатури були розроблені у 1957 році на ХІХ конгресі Міжнародного союзу
- 54. Правила утворення назви органічної речовини за IUPAC номенклатурою 1. Визначаємо в молекулі органічної речовини найдовший ланцюг
- 55. Правила утворення назви органічної речовини за IUPAC номенклатурою 3. На початку назви органічної речовини локантом (числівником)
- 56. Правила утворення назви органічної речовини за IUPAC номенклатурою 4. Назва карбонового ланцюга (кореня) утворюється від назви
- 57. Правила утворення назви органічної речовини за IUPAC номенклатурою 5. В кінці назви органічної речовини функціональну групу,
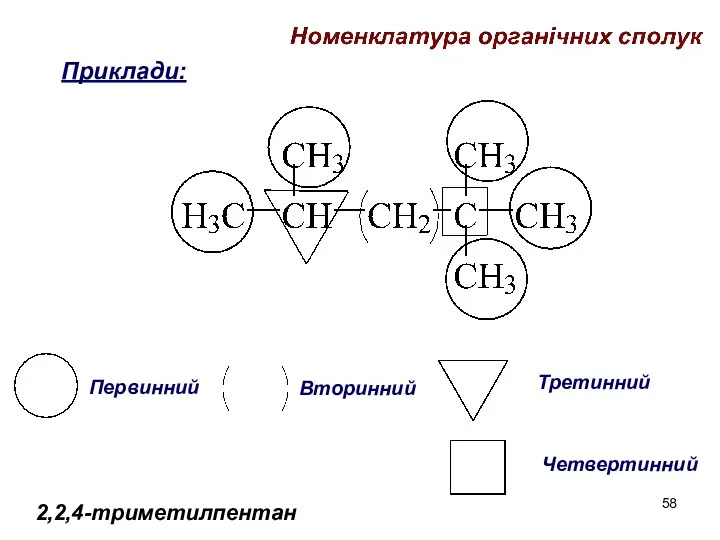
- 58. 2,2,4-триметилпентан Первинний Вторинний Третинний Четвертинний Приклади:
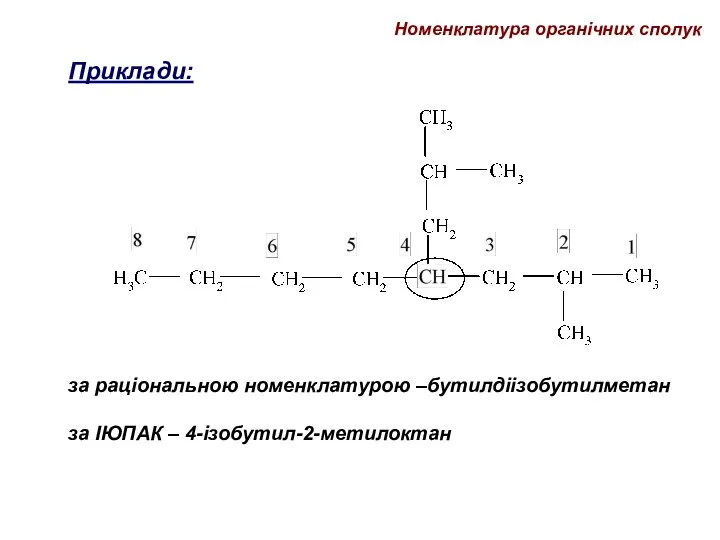
- 59. Приклади: за раціональною номенклатурою –бутилдіізобутилметан за ІЮПАК – 4-ізобутил-2-метилоктан Номенклатура органічних сполук
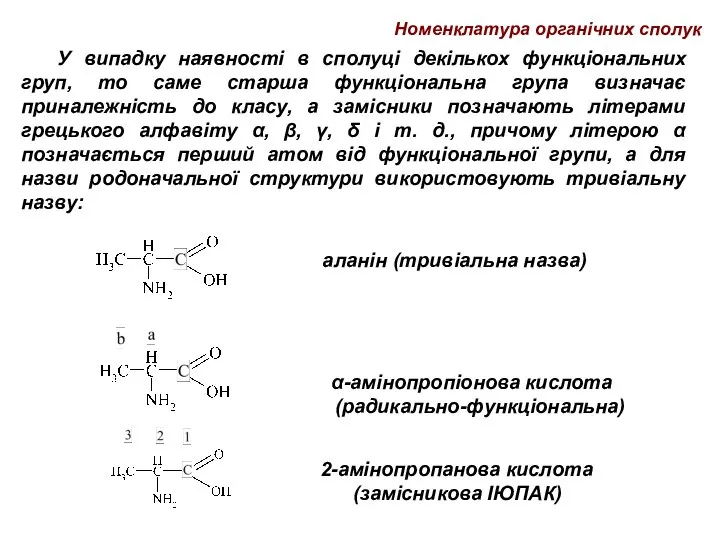
- 60. У випадку наявності в сполуці декількох функціональних груп, то саме старша функціональна група визначає приналежність до
- 61. Класифікація органічних реакцій При гетеролітичному розриві зв’язку (гетеролізі) обидва електрони зв’язку залишаються на одному з фрагментів,
- 62. Класифікація органічних реакцій Класифікація органічних реакцій за типами розриву зв’язку При гомолітичному розриві зв’язку (гомолізі) утворюються
- 63. Класифікація органічних реакцій Класифікація органічних реакцій за типами реагентів Нуклеофільні реакції – це реакції, в яких
- 64. Нуклеофіл – частинка, що в хімічній реакції виступає донором електронної пари. Електрофіл – частинка, що в
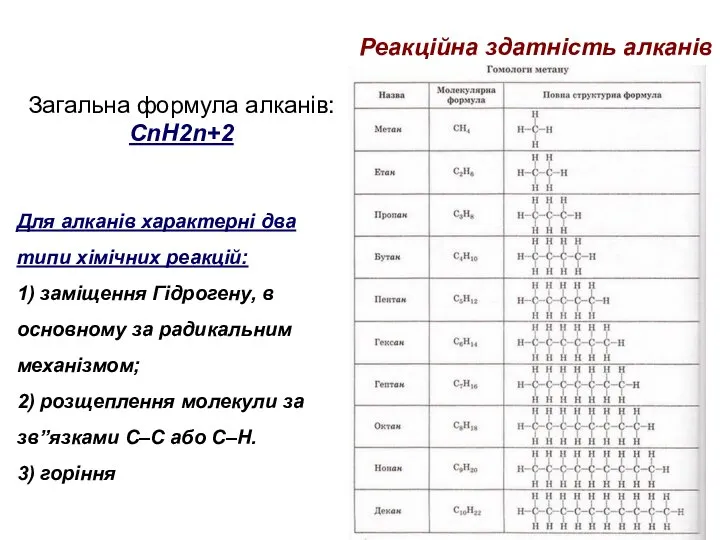
- 65. Реакційна здатність алканів Загальна формула алканів: СnH2n+2 Для алканів характерні два типи хімічних реакцій: 1) заміщення
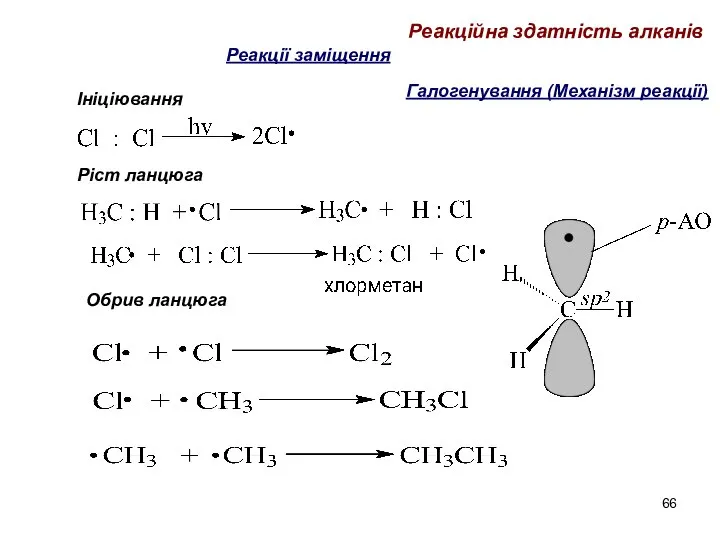
- 66. Галогенування (Механізм реакції) Ініціювання Ріст ланцюга Реакційна здатність алканів Обрив ланцюга Реакції заміщення
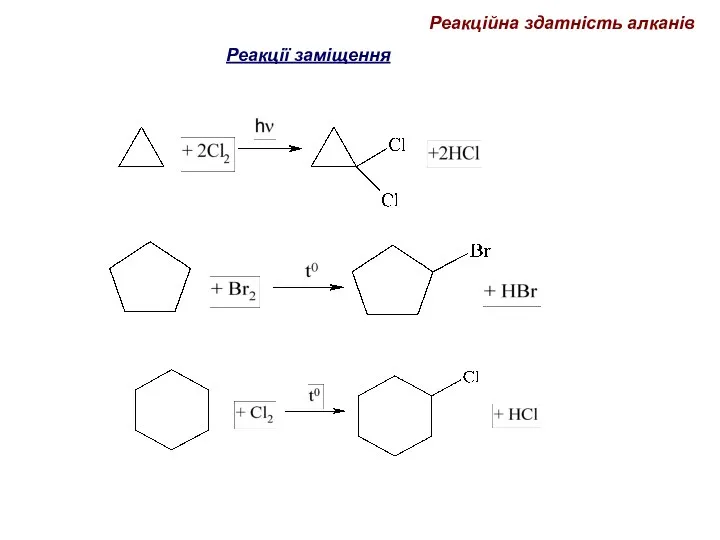
- 67. Реакційна здатність алканів Реакції заміщення
- 68. Реакційна здатність алкенів Загальна формула алканів: СnH2n Для алкенів характерні типи хімічних реакцій: 1) Реакції приєднання;
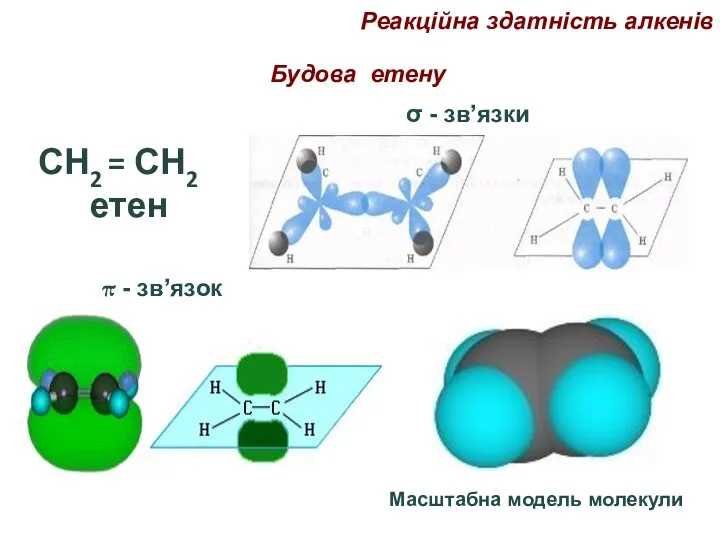
- 69. Будова етену СН2 = СН2 етен σ - зв’язки π - зв’язок Масштабна модель молекули Реакційна
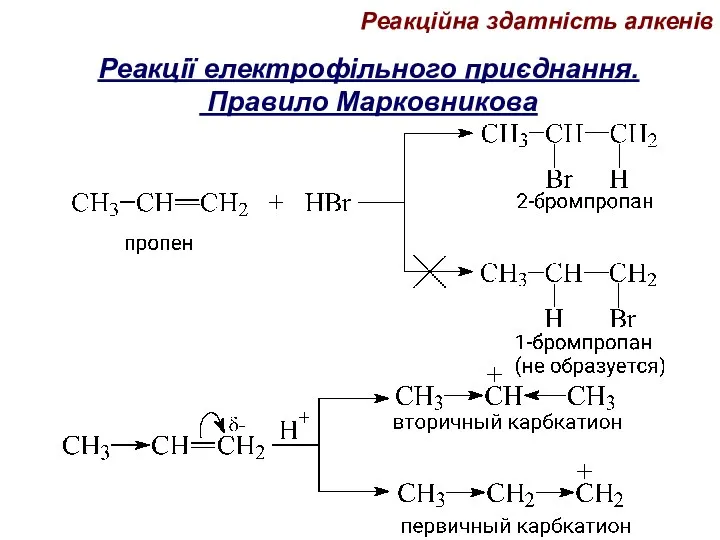
- 70. Реакції електрофільного приєднання. Правило Марковникова Реакційна здатність алкенів
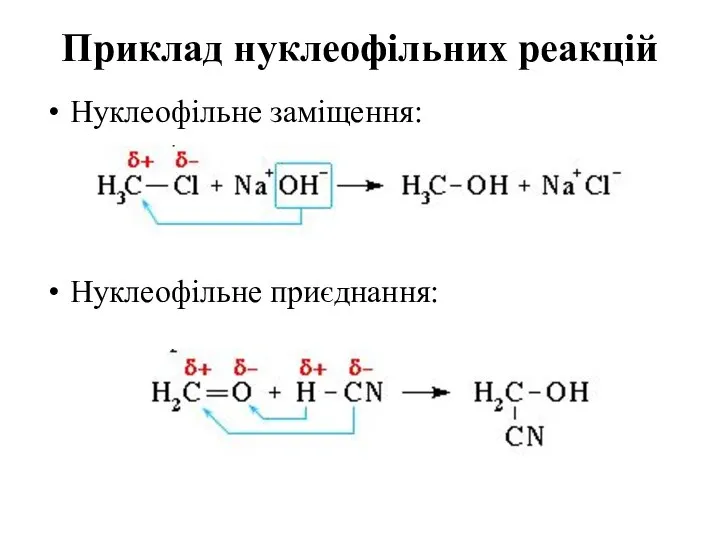
- 71. Приклад нуклеофільних реакцій Нуклеофільне заміщення: Нуклеофільне приєднання:
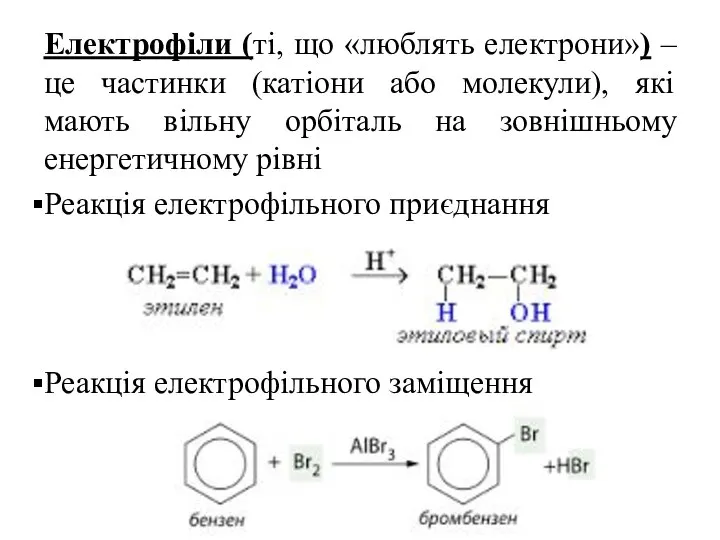
- 72. Електрофіли (ті, що «люблять електрони») – це частинки (катіони або молекули), які мають вільну орбіталь на
- 74. Скачать презентацию































 Алкадиены
Алкадиены Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Научно-познавательное шоу Юный химик
Научно-познавательное шоу Юный химик Расчет по химическим уравнениям
Расчет по химическим уравнениям Презентация на тему Влияние пищевых добавок на здоровье человека
Презентация на тему Влияние пищевых добавок на здоровье человека  Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Химия жиров (липидов)
Химия жиров (липидов) Основи масообміну
Основи масообміну География. Уральские самоцветы
География. Уральские самоцветы Общие химические свойства неметаллов
Общие химические свойства неметаллов Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Химическая лаборатория
Химическая лаборатория Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Карбоновые кислоты
Карбоновые кислоты Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Химическая коррозия
Химическая коррозия Общие способы получения металлов
Общие способы получения металлов 11 типы связей
11 типы связей Соединения азота
Соединения азота Биохимия крови
Биохимия крови Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача
Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача Гидролиз солей
Гидролиз солей Самородные металлы
Самородные металлы Презентация на тему Алканы
Презентация на тему Алканы