Содержание
- 2. Первый вариант Периодической таблицы элементов был опубликован Дмитрием Ивановичем Менделеевым в 1869 году - задолго до
- 3. Первый вариант Периодической таблицы, выглядит непривычно для современного читателя. Пока не проставлены атомные номера, будущие группы
- 4. В 1864 году англичанин Дж. Ньюлендс заметил, что если располагать элементы в порядке возрастания их атомного
- 5. Сопоставление свойств, предсказанных Д. И. Менделеевым для еще не открытого элемента "эка-силиция" со свойствами элемента германия
- 6. После многих опытов и предполагаемых гипотез ученым всего мира стало ясно, что Периодическая таблица Д. И.
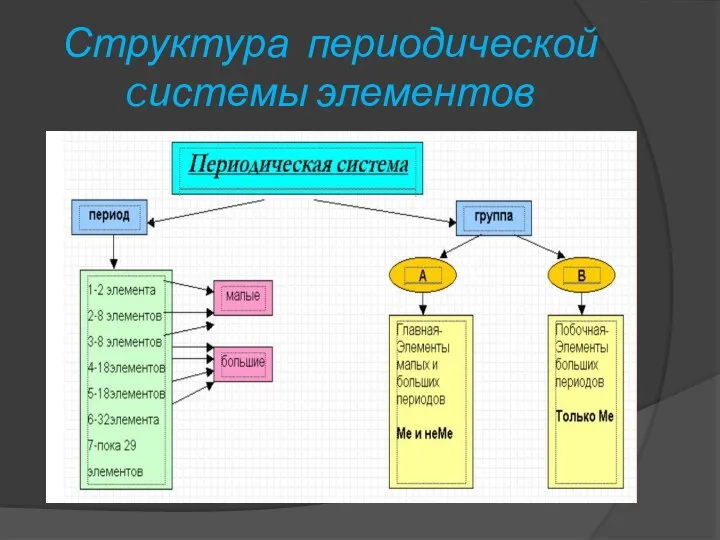
- 7. Структура периодической cистемы элементов
- 8. Период — горизонтальный ряд химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие
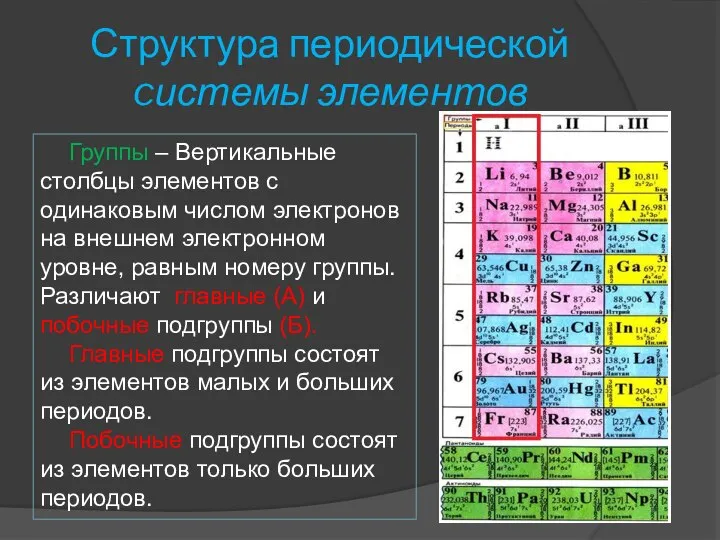
- 9. Структура периодической cистемы элементов Группы – Вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном
- 11. Скачать презентацию






 9 урок простые и сложные вещества
9 урок простые и сложные вещества Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Теория электролитической диссоциации
Теория электролитической диссоциации Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Виды работ на уроках химии
Виды работ на уроках химии Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"
Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"  Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Липиды
Липиды Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Марказит (лучистый колчедан, капельное серебро)
Марказит (лучистый колчедан, капельное серебро)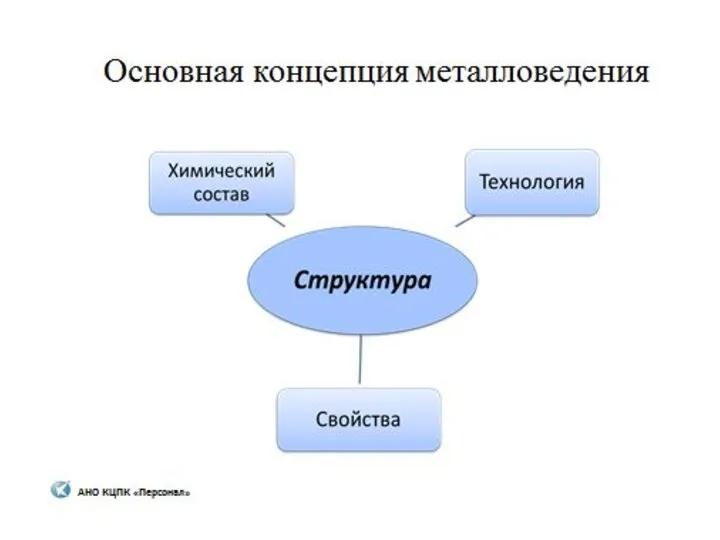 Металловедение
Металловедение Ferrum железо
Ferrum железо Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов Равновесия в растворах электролитов. Окислительно-восстановительные реакции
Равновесия в растворах электролитов. Окислительно-восстановительные реакции Кислоты с металлами
Кислоты с металлами Презентация на тему Применение солей в быту
Презентация на тему Применение солей в быту  Скорость химических реакций
Скорость химических реакций Презентация на тему Галогены в организме человека
Презентация на тему Галогены в организме человека  Титан. История открытия титана
Титан. История открытия титана Валентность
Валентность Пластмассы
Пластмассы Полимеры
Полимеры Химия в быту
Химия в быту Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Химическая термодинамика
Химическая термодинамика