Содержание
- 2. План занятия Характеристики химических связей Типы химических связей Методы описания химической связи Гибридизация атомных орбиталей. Пространственная
- 3. Фундаментальной основой химической связи явилась теория химического строения А.М. Бутлерова (1861 г.): свойства соединений зависят от
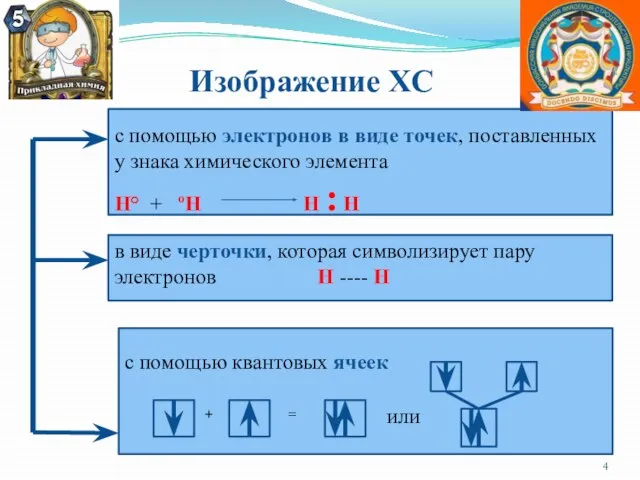
- 4. Изображение ХС с помощью электронов в виде точек, поставленных у знака химического элемента Н° + ºН
- 5. Валентность – способность атомов одного элемента соединяться с определенным количеством атомов другого элемента (для количественного определения
- 6. К основным чертам химической связи можно отнести: а) снижение общей энергии двух- или многоатомной системы по
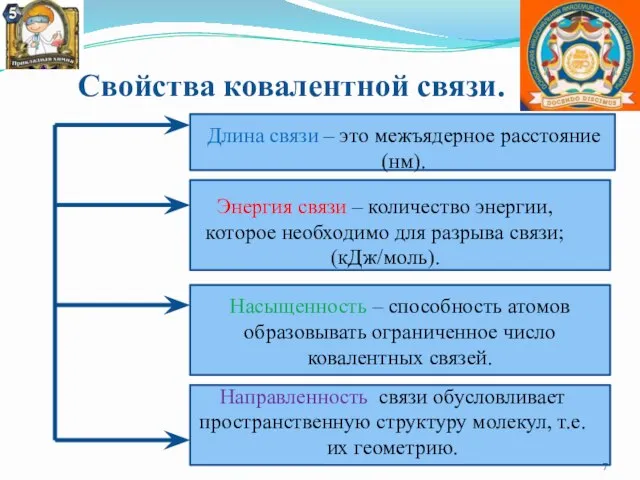
- 7. Свойства ковалентной связи. Длина связи – это межъядерное расстояние (нм). Энергия связи – количество энергии, которое
- 8. Длина химической связи (l св) - расстояние между ядрами атомов в соед-ях В однотипных соед-ях длина
- 9. Энергия связи (Есв) – это энергия, выделяющаяся при образовании хим. связи или расходуемая на её разрыв
- 10. Валентный угол образован воображаемыми линиями, соединяющими центры взаимодействующих атомов O Cl — Be — Cl H
- 11. Дипольный момент – колич-ная характеристика полярности связи (измеряется в дебаях) μ = q⋅lдип q– заряд полюса
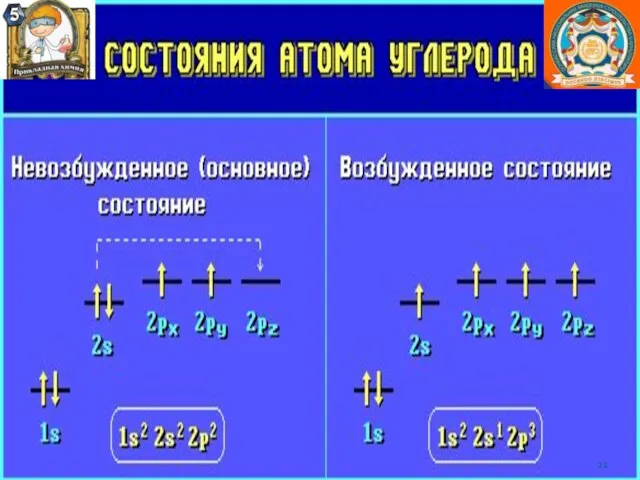
- 12. Правило октета. В результате образования химической связи атомы могут приобретать такую же электронную конфигурацию, как у
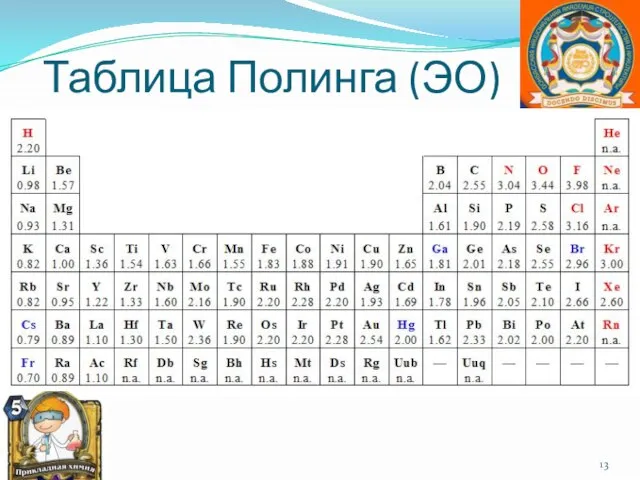
- 13. Таблица Полинга (ЭО)
- 14. Типы ХС Δ χ=0 эВ – неполярная связь КНПС Δ χ Δ χ≈0,5÷1,0 эВ – среднеполярная
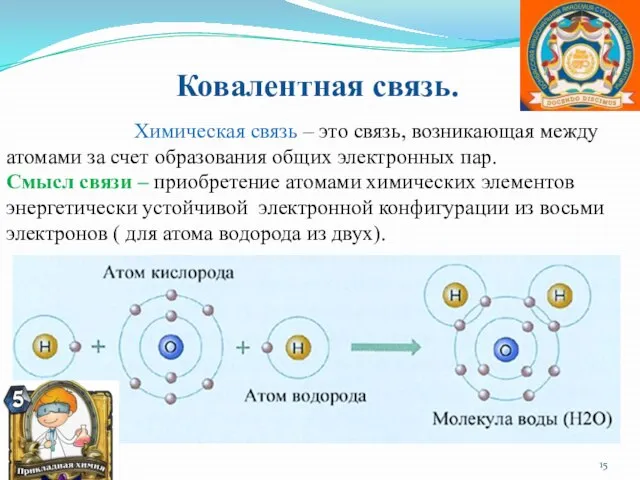
- 15. Ковалентная связь. Химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
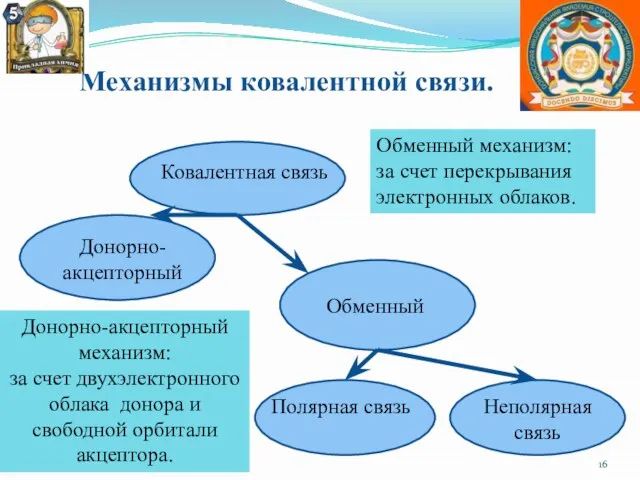
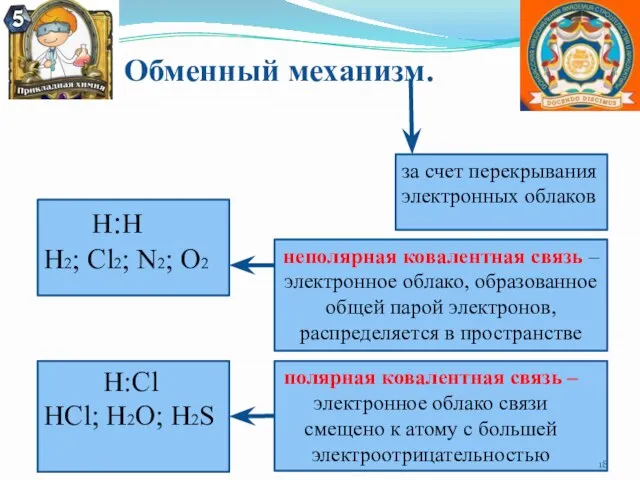
- 16. Механизмы ковалентной связи. Ковалентная связь Донорно-акцепторный Обменный Полярная связь Неполярная связь Обменный механизм: за счет перекрывания
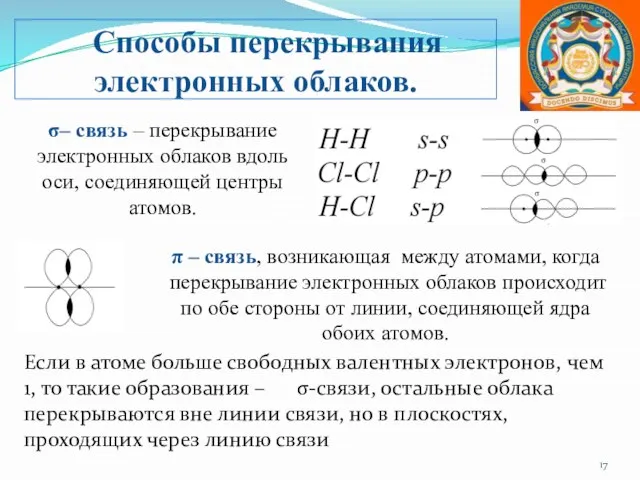
- 17. Если в атоме больше свободных валентных электронов, чем 1, то такие образования – σ-связи, остальные облака
- 18. Обменный механизм. за счет перекрывания электронных облаков Н:Н Н2; Cl2; N2; O2 неполярная ковалентная связь –
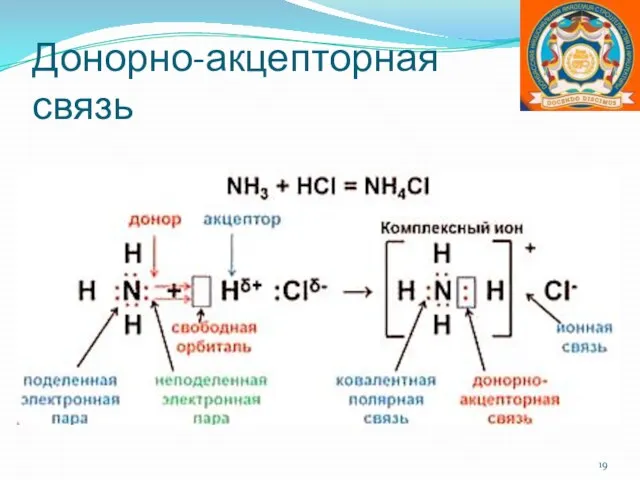
- 19. Донорно-акцепторная связь
- 20. Свойства ковалентной связи Насыщаемость –это способность атомов участвовать в образовании ограниченного числа ковалентных связей. Направленность –взаимная
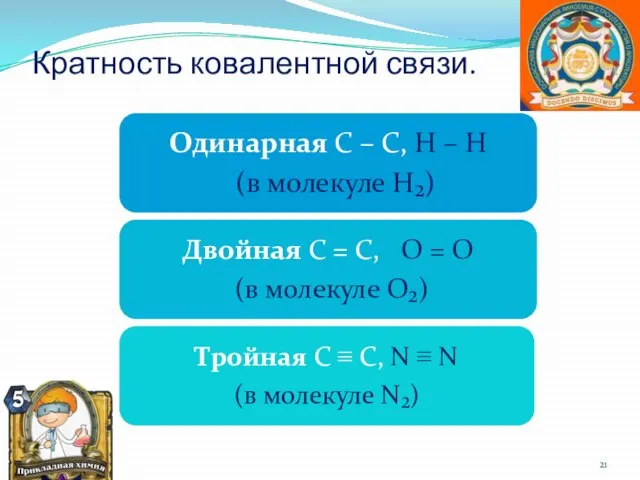
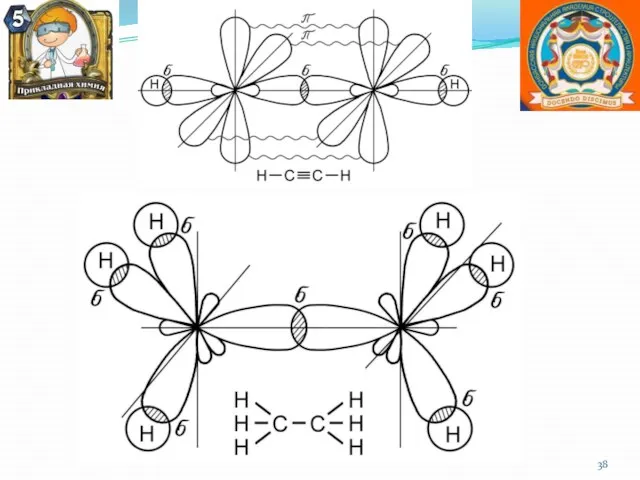
- 21. Кратность ковалентной связи.
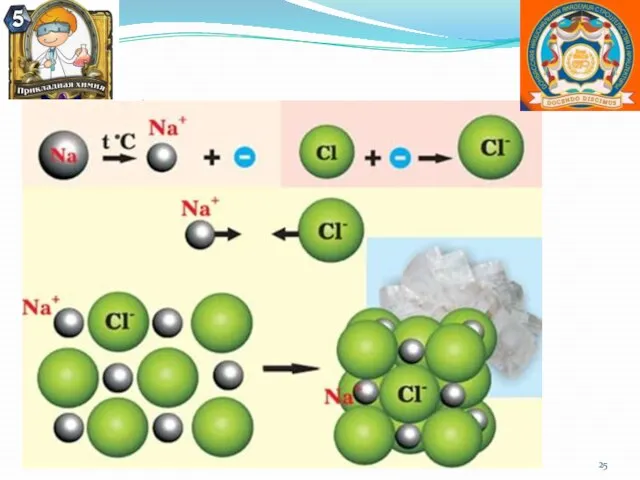
- 23. Ионная химическая связь Ионная или электровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется
- 25. Образование хлорида натрия.
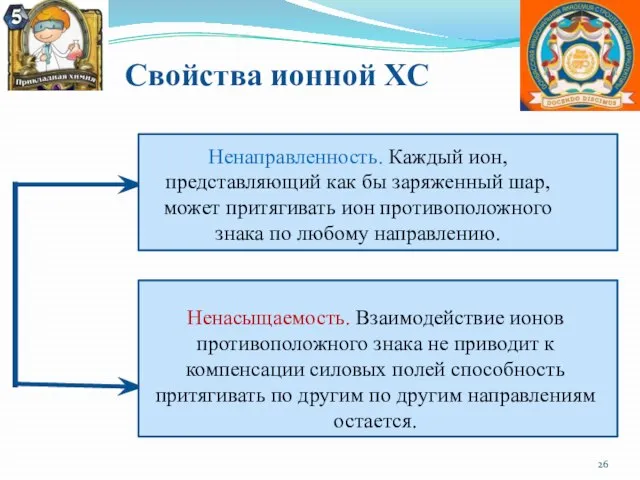
- 26. Свойства ионной ХС Ненаправленность. Каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака
- 27. Изображение ХС
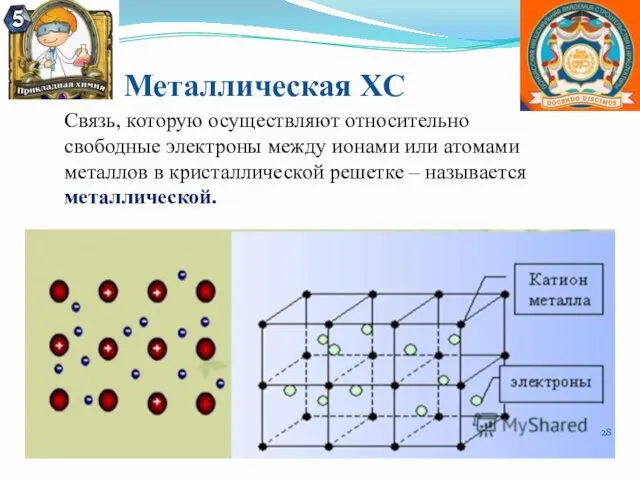
- 28. Металлическая ХС Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке
- 29. Особенности металлической связи. Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов
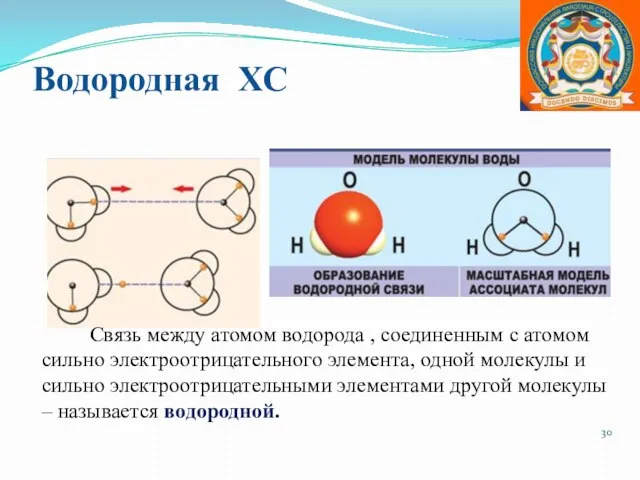
- 30. Водородная ХС Связь между атомом водорода , соединенным с атомом сильно электроотрицательного элемента, одной молекулы и
- 31. Оосбенности водородной связи Связь относится к межмолекулярной; возможно образование внутримолекулярной водородной связи. Водородная связь вторая по
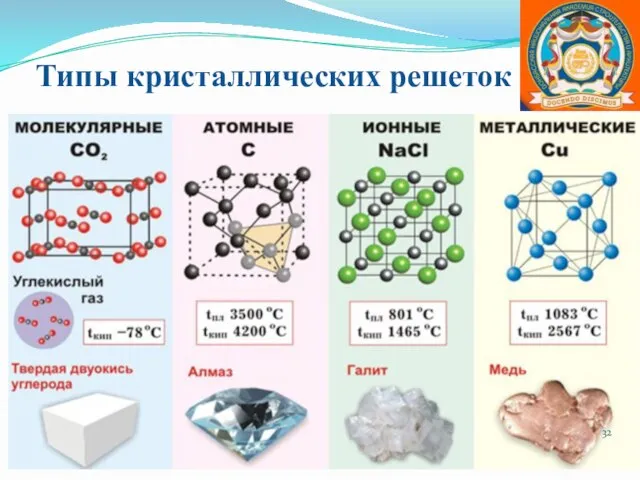
- 32. Типы кристаллических решеток
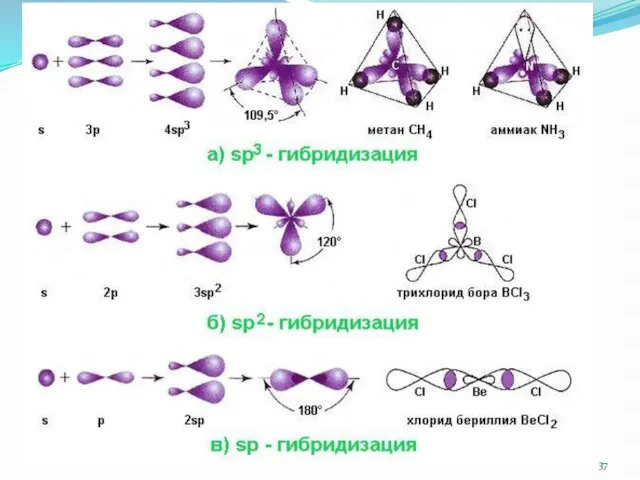
- 33. Метод валентных связей (ВС) Связанные между собой атомы в молекуле удерживаются вместе при помощи одной или
- 34. Основные положения метода ВС Ков. связь образуют два электрона с противоположными спинами, принадлежащие двум атомам При
- 35. Пример если в соединение входит кислород, то два других элемента соединяются только через кислород водород образует
- 40. Скачать презентацию



















 Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Алканы
Алканы Классификация веществ
Классификация веществ Методы активации карбоксильной группы
Методы активации карбоксильной группы Обобщение. Неметаллы
Обобщение. Неметаллы Щелочные металлы
Щелочные металлы Вода-растворитель
Вода-растворитель Жемчужины химии
Жемчужины химии Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Лаборатория гидрометаллургических процессов
Лаборатория гидрометаллургических процессов Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Нафтены и арены
Нафтены и арены Кислород и сера. Их положение в ПСХЭ. Значение и применение
Кислород и сера. Их положение в ПСХЭ. Значение и применение Презентация на тему Метан и его свойства
Презентация на тему Метан и его свойства  Электроотрицательность атомов
Электроотрицательность атомов Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Металлургия в химии
Металлургия в химии Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях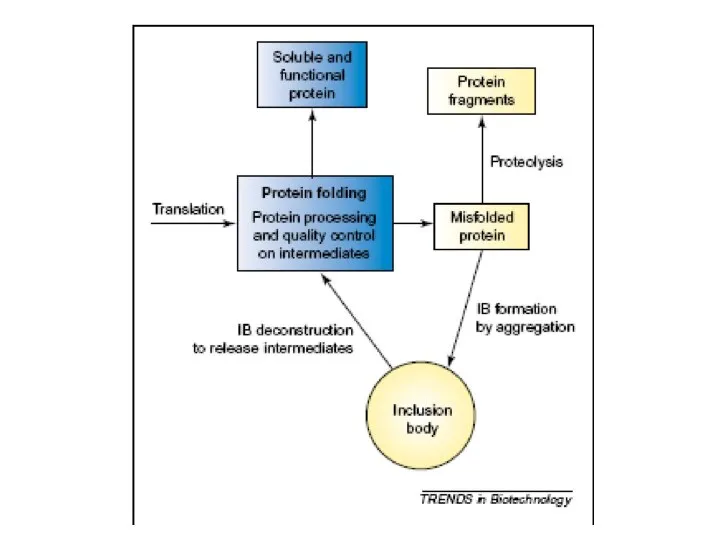 Рефолдинг миниантител
Рефолдинг миниантител Что такое кислота? Составляем общую формулу
Что такое кислота? Составляем общую формулу Презентация на тему Природный газ
Презентация на тему Природный газ  Спирты. Классификация
Спирты. Классификация Полистерол Прохоренко Е.О. 11 Б
Полистерол Прохоренко Е.О. 11 Б Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Презентация на тему Основные положения МКТ
Презентация на тему Основные положения МКТ  Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Спирты
Спирты Бериллий, магний и щелочно-земельные металлы
Бериллий, магний и щелочно-земельные металлы