Содержание
- 2. Содержание
- 3. СПИРТЫ CxHy (OH)n Спиртами называются органические вещест-ва, молекулы которых содержат одну или несколько гидроксильных групп, связанных
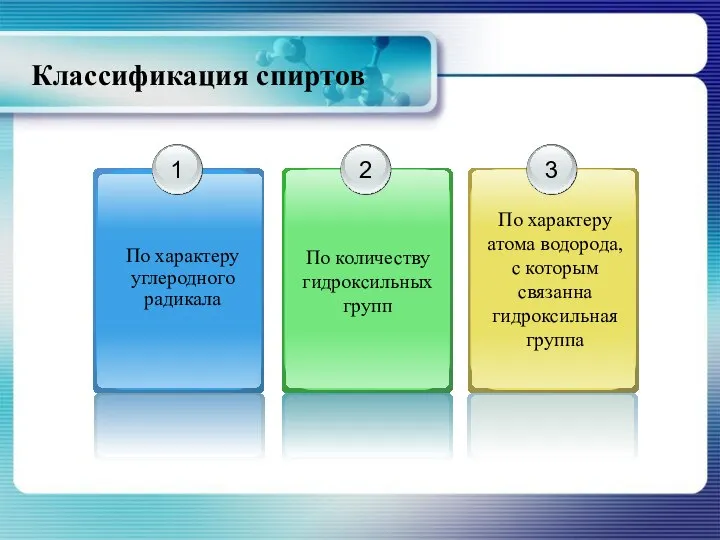
- 4. Классификация спиртов
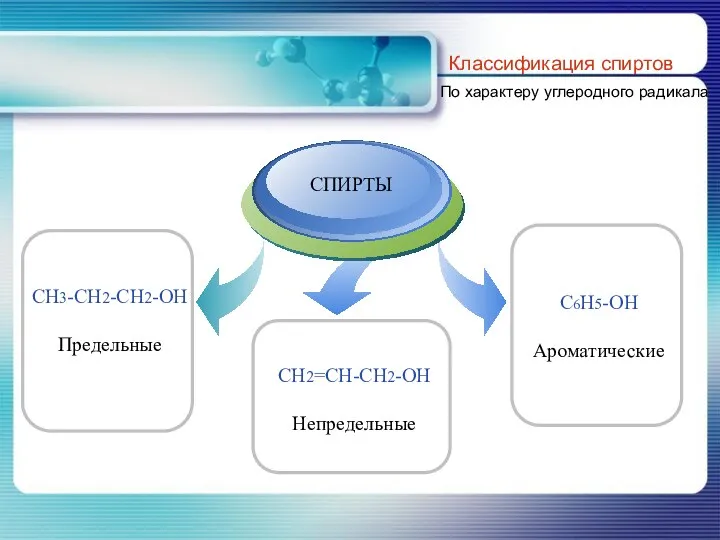
- 5. Классификация спиртов По характеру углеродного радикала
- 6. По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов совпадает с классификацией углеводородов.
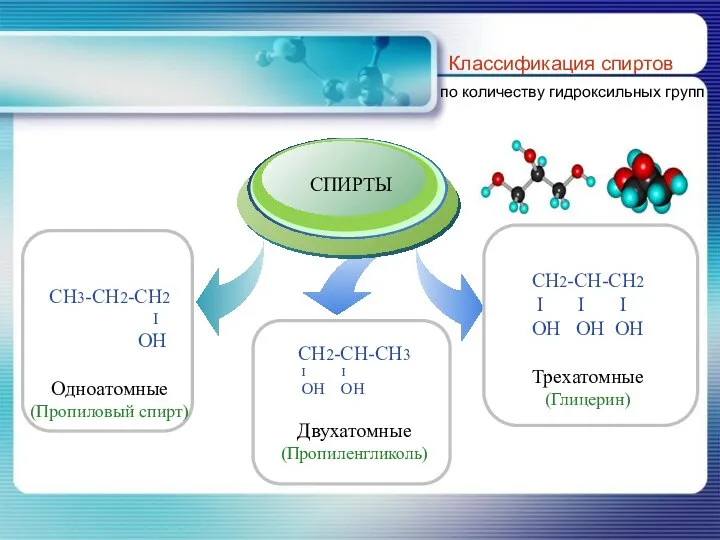
- 7. Классификация спиртов по количеству гидроксильных групп
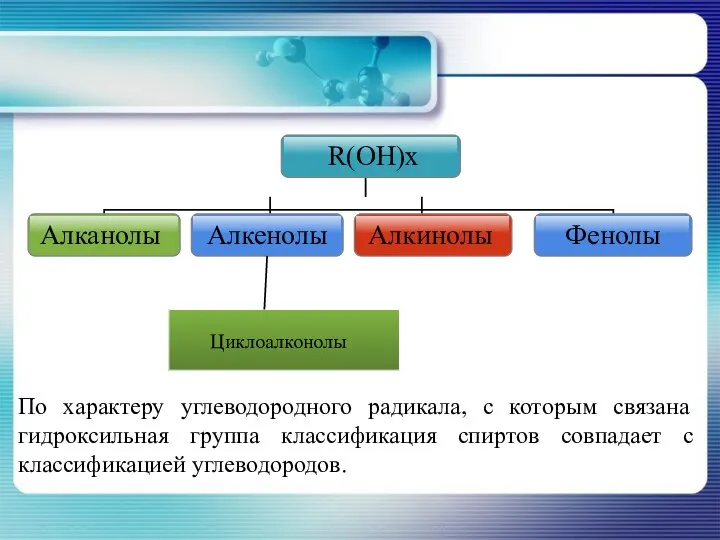
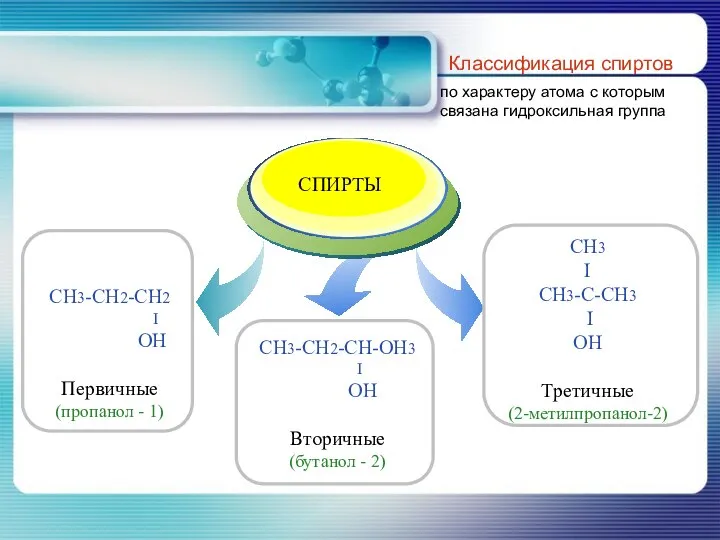
- 8. Классификация спиртов по характеру атома с которым связана гидроксильная группа
- 9. Алканолы образуют гомологический ряд общей формулы CnH2n+1OH (n=1,2,3,:N). Названия алканолов по систематичес-кой номенклатуре строятся из названий
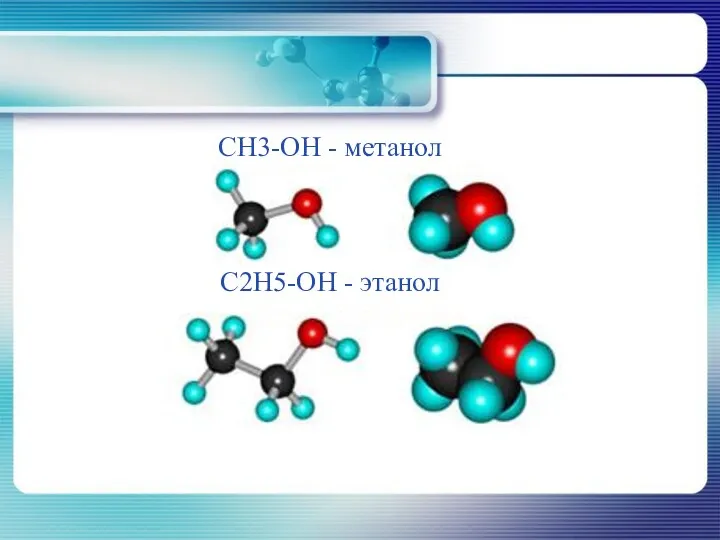
- 10. CH3-OH - метанол C2H5-OH - этанол
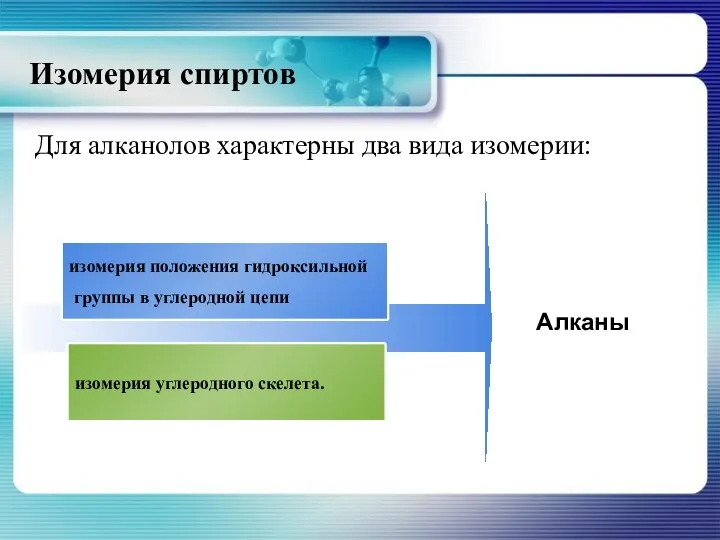
- 11. Изомерия спиртов Для алканолов характерны два вида изомерии:
- 12. Изомерия положения гидроксильной группы в углеродной цепи CH3-CH2-CH2-OH пропанол н-пропиловый спирт CH3-CH-CH3 l OH пропанол-2 (изопропиловый
- 13. CH3-CH2-CH2-CH2-OH бутанол-1 (н-бутиловый спирт) CH3-CH-CH2-OH l CH3 2-метилпропанол-1 (изобутиловый спирт) Первым из спиртов, для которого характерны
- 14. Физические свойства спиртов Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены гомологического
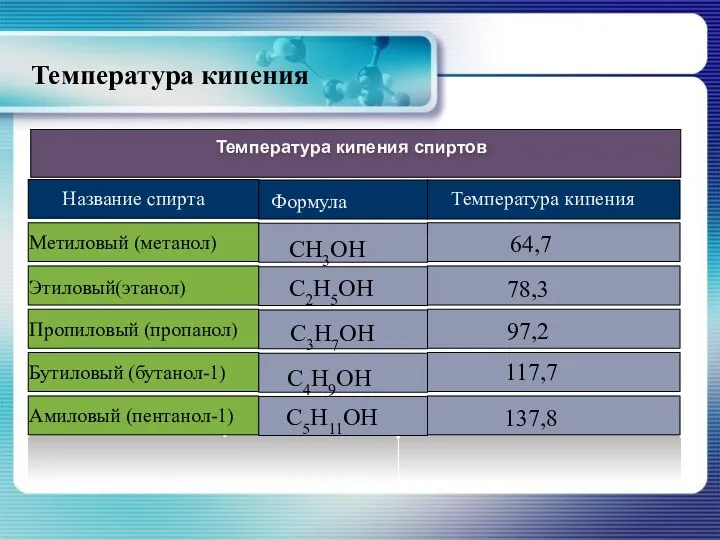
- 15. Температура кипения
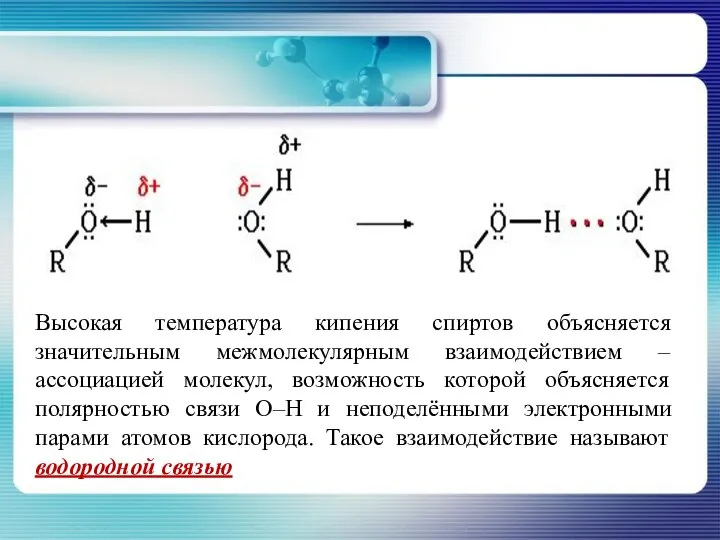
- 16. Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием – ассоциацией молекул, возможность которой объясняется полярностью связи
- 17. Строение молекулы этанола В молекуле этанола атомы углерода, водорода и кислорода связаны только одинарными - связями.
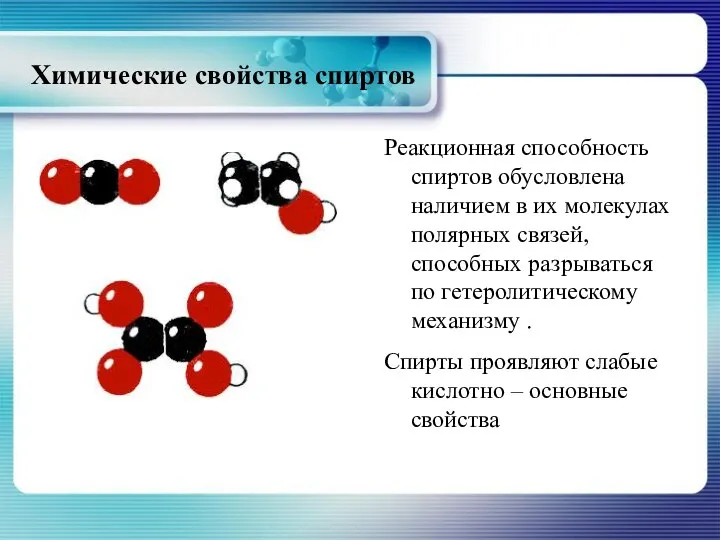
- 18. Химические свойства спиртов Реакционная способность спиртов обусловлена наличием в их молекулах полярных связей, способных разрываться по
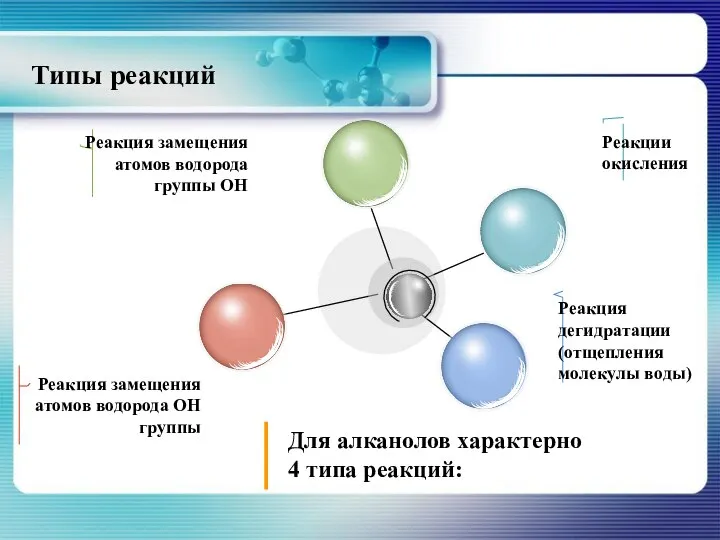
- 19. Типы реакций
- 20. Реакция замещения водорода -ОН группы С2Н5ОН + Na → C2H5ONa + H2 C2H5ONa + H2O →
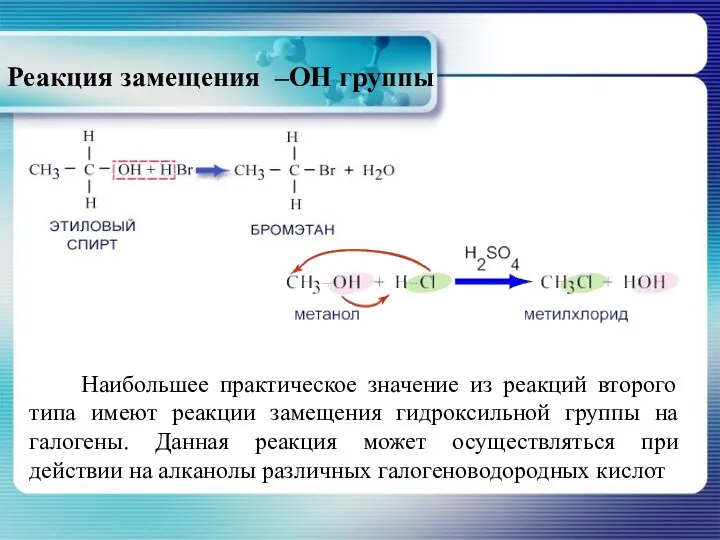
- 21. Реакция замещения –ОН группы Наибольшее практическое значение из реакций второго типа имеют реакции замещения гидроксильной группы
- 22. R – OH + H – X ↔ R – X + H2O Реакционная способность алканолов
- 23. Реакция дегидратации Для алканолов характерно два типа реакции дегидратации: - внутримолекулярная и - межмолекулярная При внутримолекулярной
- 24. Внутримолекулярная дегидратация алканолов может осуществляться при нагревании их с избытком концентрированной H2SO4 при темпе- ратуре 150-200ºС
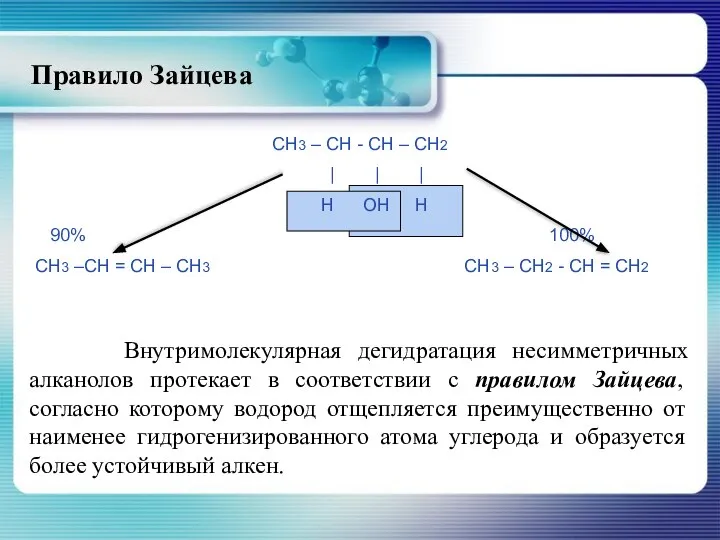
- 25. Правило Зайцева Внутримолекулярная дегидратация несимметричных алканолов протекает в соответствии с правилом Зайцева, согласно которому водород отщепляется
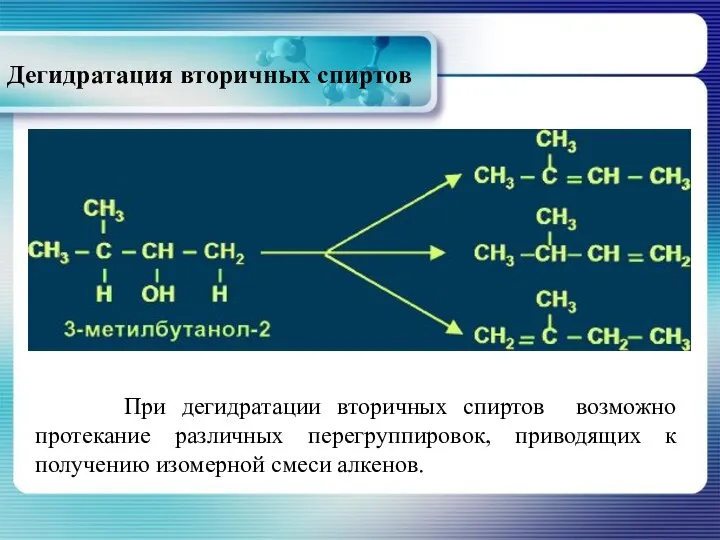
- 26. Дегидратация вторичных спиртов При дегидратации вторичных спиртов возможно протекание различных перегруппировок, приводящих к получению изомерной смеси
- 27. При более слабом нагревании этилового спирта с серной кислотой образуется диэтиловый эфир. Это летучая, легко воспламеняющаяся
- 28. Реакции окисления Окисление спиртов проис-ходит и под действием силь-ных окислителей. Характер получаемых при этом продук-тов определяется
- 30. Окисление первичных спиртов до карбоновых кислот протекает при действии HNO3 или перманганата калия в щелочной среде.
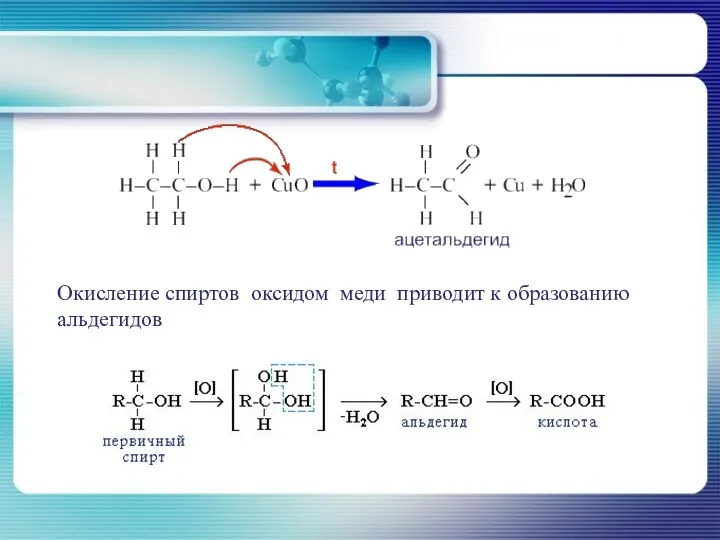
- 31. Окисление спиртов оксидом меди приводит к образованию альдегидов
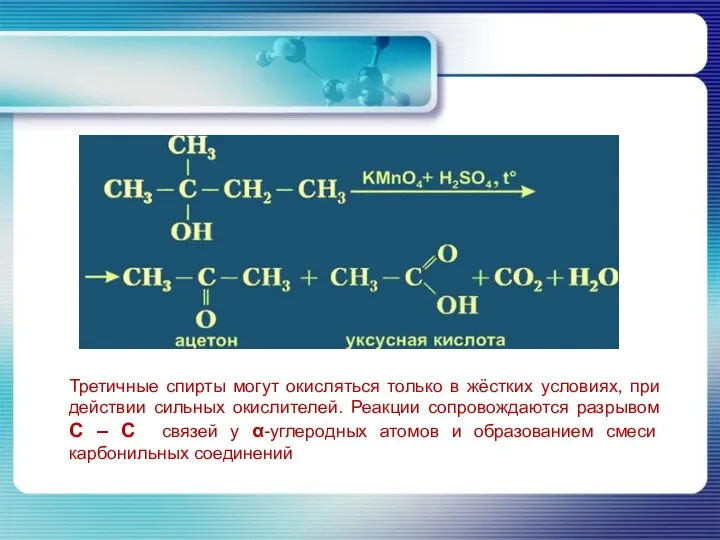
- 32. Третичные спирты могут окисляться только в жёстких условиях, при действии сильных окислителей. Реакции сопровождаются разрывом С
- 33. Метанол и этанол Метанол получают гидрированием оксида углерода (II) СО. В настоящее время разработан способ получения
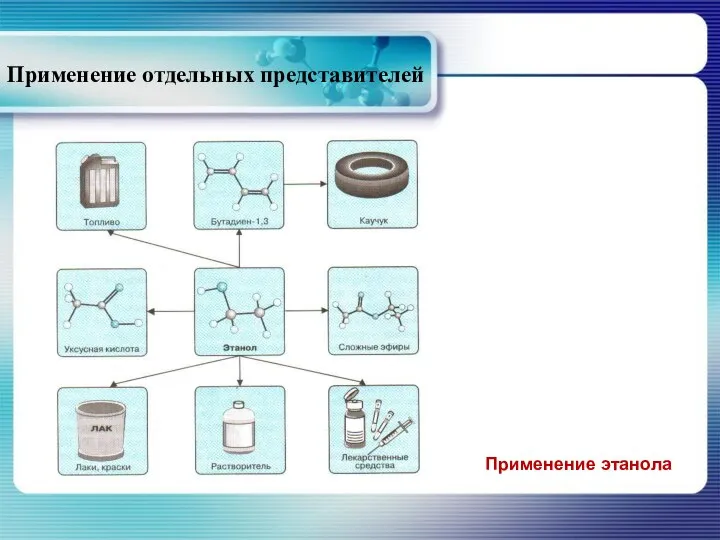
- 34. Применение отдельных представителей Применение этанола
- 35. Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
- 36. Мировое производство мета-нола составляет около 10 мил-лионов тонн в год, этанола производится примерно на порядок больше.
- 37. Запомни Водородная связь – это связь между атомом водорода одной молекулы и атомами с большой электоотрицательностью
- 39. Скачать презентацию


















 Значимые личности в химии
Значимые личности в химии Простые вещества в стране Химляндии. 8 класс
Простые вещества в стране Химляндии. 8 класс Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Предмет органической химии. Особенности органических веществ
Предмет органической химии. Особенности органических веществ Соли, их классификация и свойства
Соли, их классификация и свойства Характеристика кислорода и серы
Характеристика кислорода и серы Уравнение состояния идеального газа
Уравнение состояния идеального газа Сухой метод определения глюкозы. Глюкометры
Сухой метод определения глюкозы. Глюкометры Презентация на тему Алюминий
Презентация на тему Алюминий  Изомерия и ее виды
Изомерия и ее виды Химическая связь
Химическая связь Кремний и его соединения
Кремний и его соединения Воздух
Воздух Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Основные понятия в химии
Основные понятия в химии Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Азот N2
Азот N2 Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18 Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия
Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Презентация на тему Показатели воды - её жесткость и кислотность
Презентация на тему Показатели воды - её жесткость и кислотность