Содержание
- 2. Приближенные методы описания кинетики сложных реакций Метод квазистационарных концентраций (МКСК) Метод квазиравновесных концентраций – (МКРК) Метод
- 3. Принцип детального равновесия Принцип детального равновесия (принцип микрообратимости) Если в сложном процессе устанавливается химическое равновесие, то
- 4. Приближенные методы описания кинетики сложных реакций Метод квазиравновесных концентраций – (МКРК) работает при наличии в механизме
- 5. Метод лимитирующей стадии В любой сложной реакции можно выделить самую медленную стадию. Такую стадию называют скоростьопределяющей
- 6. Пример 1 стадия процесса является лимитирующая: A + B = X A + B ? X
- 7. И кто сказал, что сложно ?
- 8. Цепные радикальные реакции Радикальная реакция, в которой превра-щение исходных веществ в продукты осуществляется путем многократного циклического
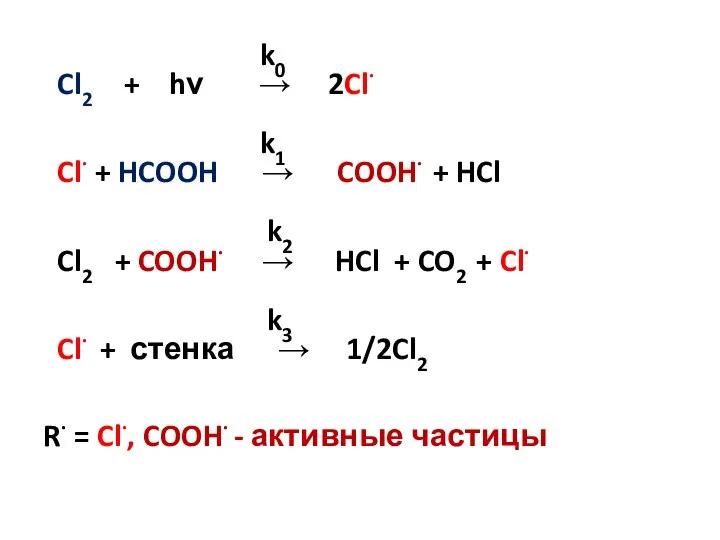
- 9. k0 Cl2 + hν → 2Cl· k1 Cl· + HCOOH → COOH· + HCl k2 Cl2
- 10. Цепной характер реакции Механизм такого процесса можно представить как регулярное чередование нескольких последовательных реакций, например: r1
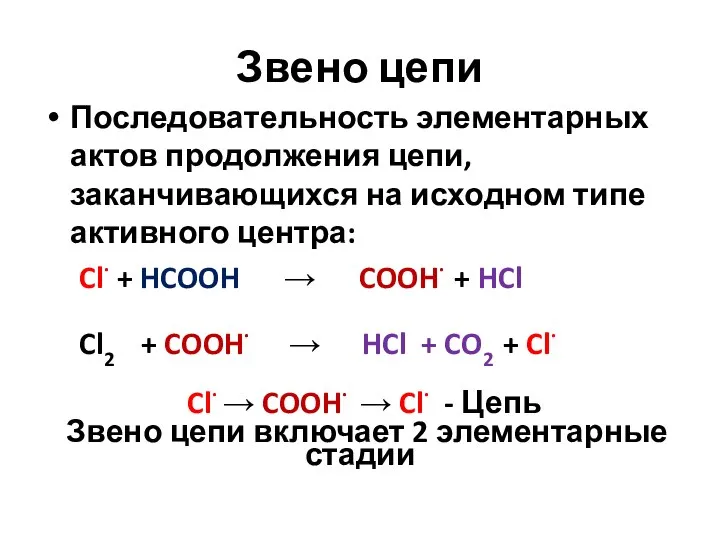
- 11. Звено цепи Последовательность элементарных актов продолжения цепи, заканчивающихся на исходном типе активного центра: Cl· + HCOOH
- 12. Основные стадии цепного процесса Стадия зарождения (инициирования) цепи Стадии продолжения цепи Стадии разветвления цепи (для разветвленных
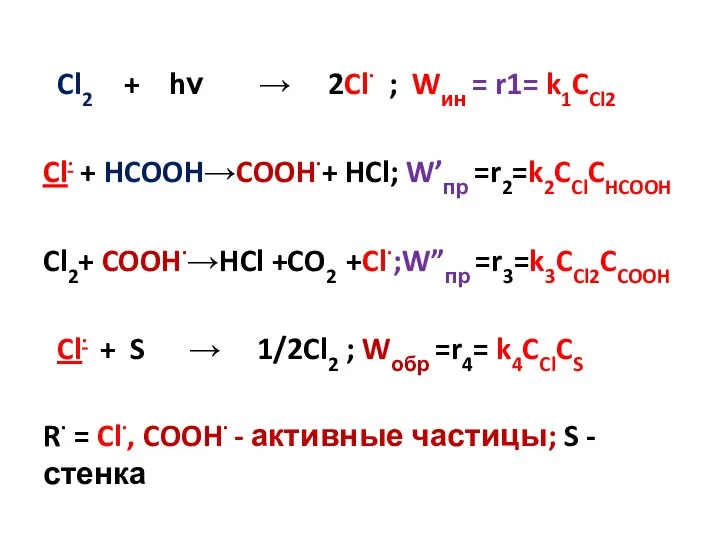
- 13. Стадии зарождения цепи Это стадии, в которой образуются исходные активные частицы. Зарождение (инициирования) цепи может быть
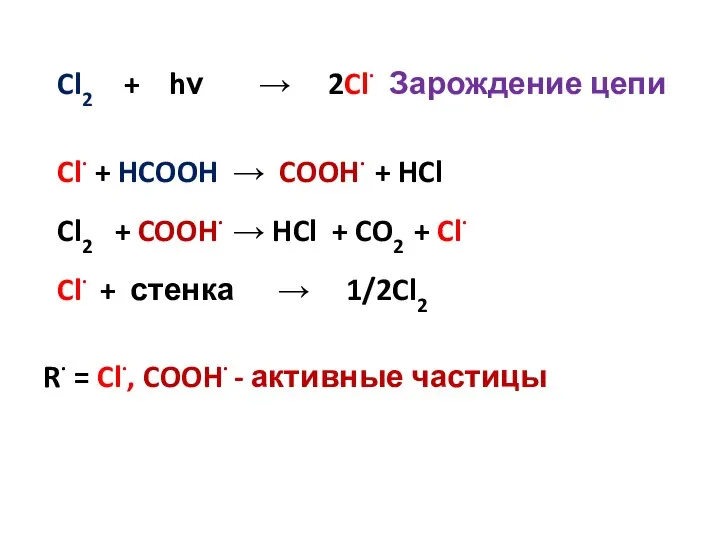
- 14. Cl2 + hν → 2Cl· Зарождение цепи Cl· + HCOOH → COOH· + HCl Cl2 +
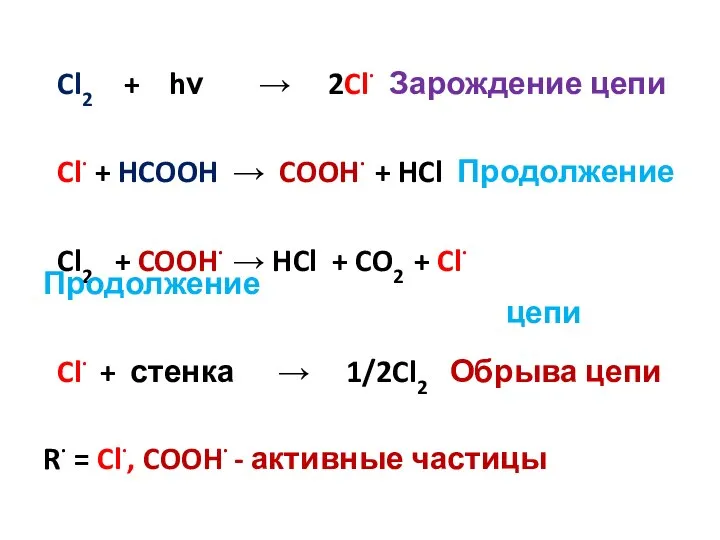
- 15. Cтадии продолжения цепи Это стадии, в которых образуются продукты реакции и новые радикалы (Принцип неуничтожимости свободной
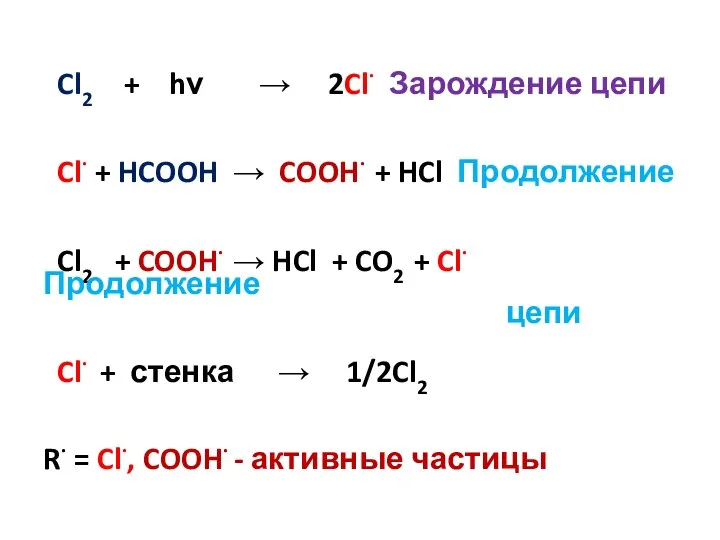
- 16. Cl2 + hν → 2Cl· Зарождение цепи Cl· + HCOOH → COOH· + HCl Продолжение Cl2
- 17. Стадия обрыва цепи Обрыв цепи - гибель активного центра, которая происходит в случае : 1) Реакции
- 18. Cl2 + hν → 2Cl· Зарождение цепи Cl· + HCOOH → COOH· + HCl Продолжение Cl2
- 19. Интересно - Гель-эффект Ускорение полимеризации с увеличением вязкости раствора. Гель-эффект проявляется в том, что начиная с
- 20. Типы цепных реакций Неразветвленная цепная реакция ( рассмотренная выше реакция) Разветвленная цепная реакция . Характеризуется появлением
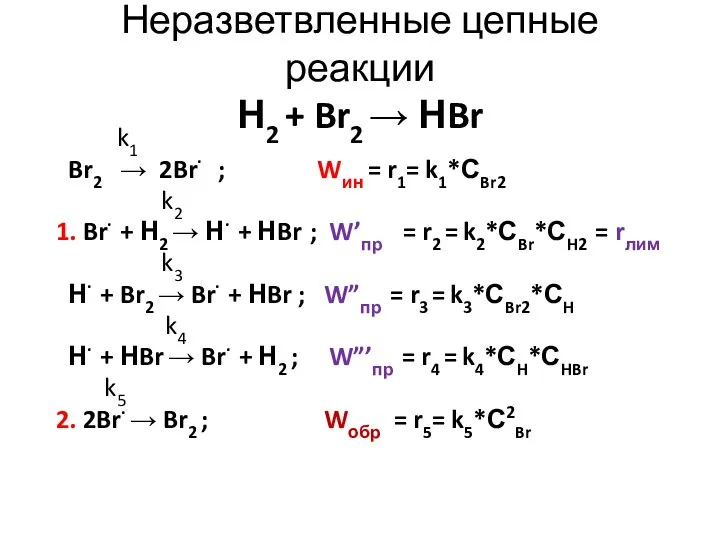
- 21. Неразветвленные цепные реакции Н2 + Br2 → НBr k1 Br2 → 2Br· ; Wин = r1=
- 22. Вывод уравнения для WHBr
- 26. Неразветвленные цепные реакции Н2 + Br2 → НBr k1 Br2 → 2Br· ; Wин = r1=
- 27. Метод приближения коротких цепей Если Wин ≥ Wобр , то процесс образования продуктов реакции протекает не
- 28. Метод приближения коротких цепей Лимитирующая стадия процесса может находится только в стадиях продолжения цепи Wпр .
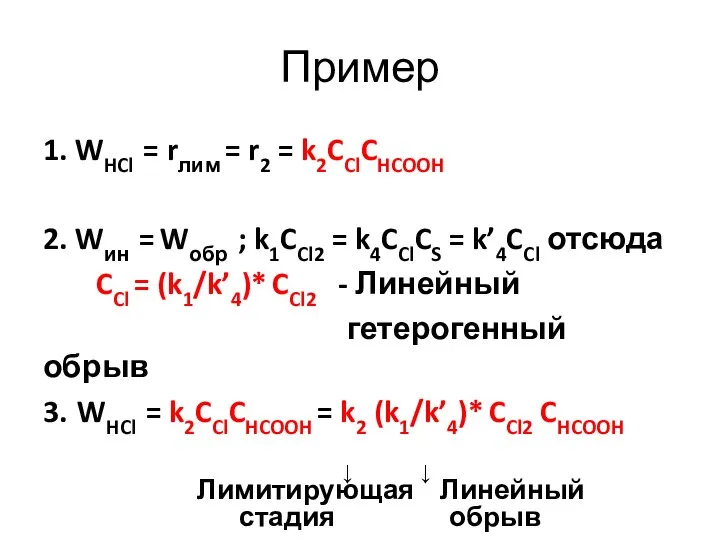
- 29. Cl2 + hν → 2Cl· ; Wин = r1= k1CCl2 Cl· + HCOOH→COOH·+ HCl; W’пр =r2=k2CClCHCOOH
- 30. Пример 1. WHCl = rлим = r2 = k2CClCHCOOH 2. Wин = Wобр ; k1CCl2 =
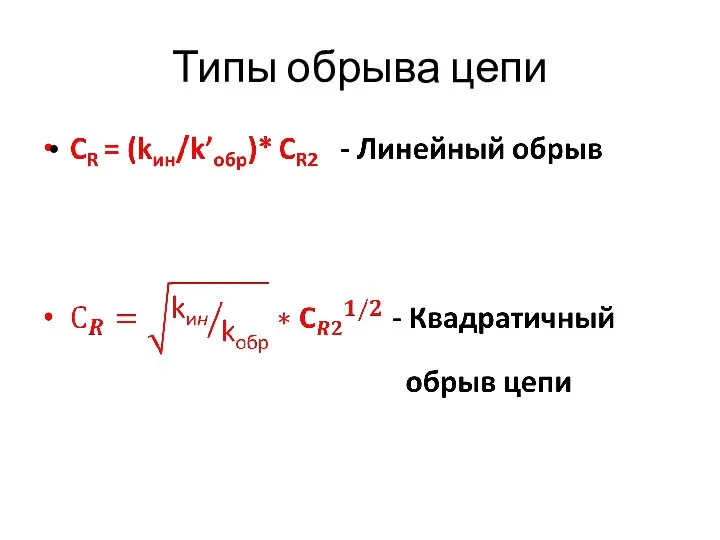
- 31. Типы обрыва цепи
- 32. Разветвленные цепные реакции Н.Н. Семенов открыл цепные реакции нового типа, названные им разветвленными. С ростом температуры
- 33. Ученые Советский физико-химик, один из основоположников химической физики. Академик АН СССР, единст-венный советский лауреат Нобелевской премии
- 34. Цепные разветвленные реакции. Все известные цепные разветвленные реакции экзотермичны: ΔH, кДж/моль 2H2 + O2 = 2H2O
- 35. Константы скорости стадий горения водорода 2H2 + O2 = 2H2O
- 36. Цепные разветвленные реакции.
- 37. Цепной характер реакции Имеем две цепи: r2 r3 OH∙ ? H∙ ? OH∙ r3 r4 H∙
- 38. Метод полустационарных концентраций WO = r3 - r4 =0 ? r3 = r4 ; WOH =
- 40. Полуостров воспламенения Полуостров воспламенения (взрыва) для стехиометрической смеси водорода с кислородом для случая f > g
- 41. Влияние различных факторов
- 44. Гель-эффект. Ускорение полимеризации с увеличением вязкости раствора. Гель-эффект проявляется в том, что начиная с некоторой глубины
- 46. Скачать презентацию


































 Значимые личности в химии
Значимые личности в химии Простые вещества в стране Химляндии. 8 класс
Простые вещества в стране Химляндии. 8 класс Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Предмет органической химии. Особенности органических веществ
Предмет органической химии. Особенности органических веществ Соли, их классификация и свойства
Соли, их классификация и свойства Характеристика кислорода и серы
Характеристика кислорода и серы Уравнение состояния идеального газа
Уравнение состояния идеального газа Сухой метод определения глюкозы. Глюкометры
Сухой метод определения глюкозы. Глюкометры Презентация на тему Алюминий
Презентация на тему Алюминий  Изомерия и ее виды
Изомерия и ее виды Химическая связь
Химическая связь Кремний и его соединения
Кремний и его соединения Воздух
Воздух Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Основные понятия в химии
Основные понятия в химии Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Азот N2
Азот N2 Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18 Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия
Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия Подготовка газа к транспорту с применением процесса низкотемпературной сепарации
Подготовка газа к транспорту с применением процесса низкотемпературной сепарации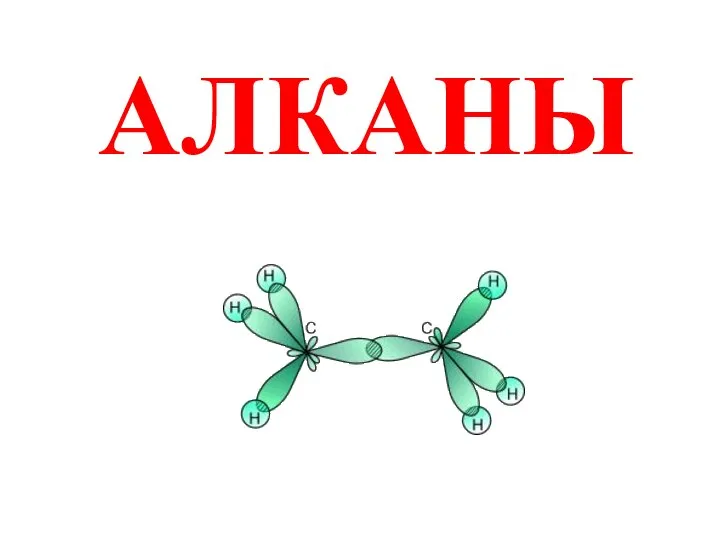 Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Презентация на тему Показатели воды - её жесткость и кислотность
Презентация на тему Показатели воды - её жесткость и кислотность