Содержание
- 2. Основные понятия Атом – мельчайшая химически неделимая нейтральная частица, которая состоит из положительно заряженного ядра и
- 3. Изотоны – это разновидности атомов разных химических элементов, имеющие одинаковое количество нейтронов, но разные атомные номера.
- 4. Электроная формула Порядок заполнения орбиталей: 1s Увеличение энергии орбиталей Принцип Паули На каждой орбитали могут находиться
- 5. Строение электронных оболочек атомов второго периода vk.com/chemistryogeege
- 7. Скачать презентацию
Слайд 2Основные понятия
Атом – мельчайшая химически неделимая нейтральная частица, которая состоит из положительно
Основные понятия
Атом – мельчайшая химически неделимая нейтральная частица, которая состоит из положительно

заряженного ядра и двигающихся вокруг него отрицательно заряженных электронов.
Состав ядра:
Протонное число (Z) – величина, показывающая число протонов в ядре.
Нейтронное число (N) – величина, показывающая число нейтронов в ядре.
Массовое число (А) – величина, показывающая общее число протонов и нейтронов в ядре.
A=Z+N
Нуклиды – это разновидности атомных ядер с фиксированным массовым числом А, числом протонов Z и нейтронов N.
Нуклид обозначается следующим образом: внизу слева записывается число протонов Z (порядковый номер), вверху слева указывается массовое число A:
ZRA
Изотопы – разновидности атомов одного химического элемента, имеющие одинаковые заряды ядер, но разные массовые числа.
Например, 8О16 ; 8О17
Состав ядра:
Протонное число (Z) – величина, показывающая число протонов в ядре.
Нейтронное число (N) – величина, показывающая число нейтронов в ядре.
Массовое число (А) – величина, показывающая общее число протонов и нейтронов в ядре.
A=Z+N
Нуклиды – это разновидности атомных ядер с фиксированным массовым числом А, числом протонов Z и нейтронов N.
Нуклид обозначается следующим образом: внизу слева записывается число протонов Z (порядковый номер), вверху слева указывается массовое число A:
ZRA
Изотопы – разновидности атомов одного химического элемента, имеющие одинаковые заряды ядер, но разные массовые числа.
Например, 8О16 ; 8О17
АТОМ
ЯДРО
ЭЛЕКТРОНЫ (е)
ПРОТОНЫ (р)
Нейтроны (n)
vk.com/chemistryogeege
Слайд 3Изотоны – это разновидности атомов разных химических элементов, имеющие одинаковое количество нейтронов,
Изотоны – это разновидности атомов разных химических элементов, имеющие одинаковое количество нейтронов,

но разные атомные номера.
Например, 88Ra228 ; 90Th230
Изобары - это разновидности атомов разных химических элементов, имеющих одинаковые массовые числа, но разные атомные номера.
Например, 18Ar40 ; 19K40
Орбиталь. Вид и форма орбиталей.
Орбиталь – это пространство вокруг ядра, в котором нахождение электрона наиболее вероятно.
Вид и форма орбиталей:
s-орбиталь:
p-орбиталь:
d- , f- , g-орбитали имеют более сложную форму.
Например, 88Ra228 ; 90Th230
Изобары - это разновидности атомов разных химических элементов, имеющих одинаковые массовые числа, но разные атомные номера.
Например, 18Ar40 ; 19K40
Орбиталь. Вид и форма орбиталей.
Орбиталь – это пространство вокруг ядра, в котором нахождение электрона наиболее вероятно.
Вид и форма орбиталей:
s-орбиталь:
p-орбиталь:
d- , f- , g-орбитали имеют более сложную форму.
Обозначения орбиталей:
-свободная орбиталь;
-орбиталь с одним электроном;
-заполненная орбиталь.
vk.com/chemistryogeege
Слайд 4Электроная формула
Порядок заполнения орбиталей:
1s < 2s < 2p < 3s < 3p
Электроная формула
Порядок заполнения орбиталей:
1s < 2s < 2p < 3s < 3p
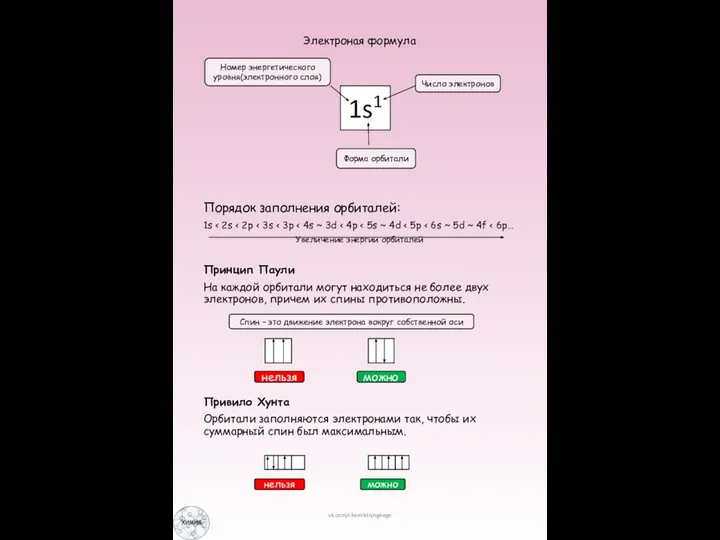
< 4s ~ 3d < 4p < 5s ~ 4d < 5p < 6s ~ 5d ~ 4f < 6p…
Увеличение энергии орбиталей
Принцип Паули
На каждой орбитали могут находиться не более двух электронов, причем их спины противоположны.
Привило Хунта
Орбитали заполняются электронами так, чтобы их суммарный спин был максимальным.
Увеличение энергии орбиталей
Принцип Паули
На каждой орбитали могут находиться не более двух электронов, причем их спины противоположны.
Привило Хунта
Орбитали заполняются электронами так, чтобы их суммарный спин был максимальным.
1s1
Номер энергетического уровня(электронного слоя)
Число электронов
Форма орбитали
Спин – это движение электрона вокруг собственной оси
нельзя
можно
нельзя
можно
vk.com/chemistryogeege
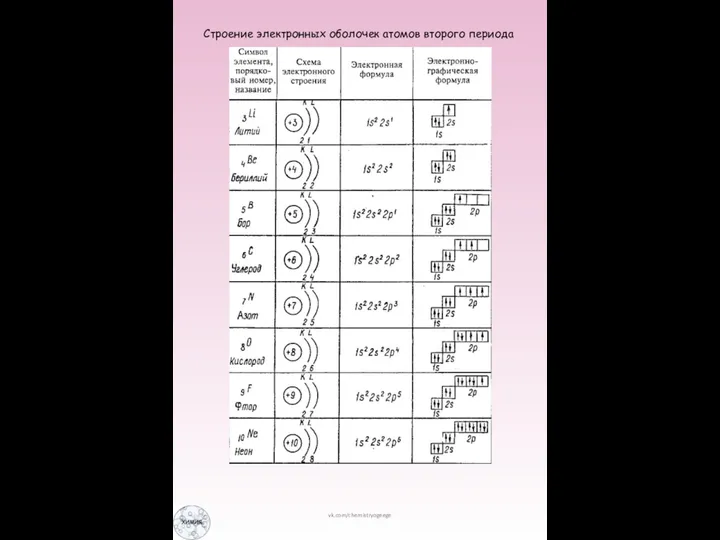
Слайд 5Строение электронных оболочек атомов второго периода
vk.com/chemistryogeege
Строение электронных оболочек атомов второго периода
vk.com/chemistryogeege
 ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области
ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Презентация на тему Медь
Презентация на тему Медь  Металлы и их соединения
Металлы и их соединения Применение коллоидных систем
Применение коллоидных систем Презентация на тему Нефть. Свойства, состав, переработка
Презентация на тему Нефть. Свойства, состав, переработка  Физическая химия
Физическая химия Способы очистки питьевой воды
Способы очистки питьевой воды Косметические средства. Виды, состав и влияние на организм
Косметические средства. Виды, состав и влияние на организм Углерод
Углерод Презентация на тему Лекарства 10 класс
Презентация на тему Лекарства 10 класс  Вода - это жизнь
Вода - это жизнь Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Стекло. Лекция №22
Стекло. Лекция №22 Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1
Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1 Удивительные свойства латекса и его применение
Удивительные свойства латекса и его применение Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Ароматические углеводороды. Галогенопроизводные
Ароматические углеводороды. Галогенопроизводные Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Селективное каталитическое восстановление оксидов азота
Селективное каталитическое восстановление оксидов азота Отчет по ПП 03.01. Лаборант химического анализа
Отчет по ПП 03.01. Лаборант химического анализа Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях Вода знакомая и не знакомая
Вода знакомая и не знакомая Синтетические высокомолекулярные органические вещества
Синтетические высокомолекулярные органические вещества Массовые доли веществ задачи
Массовые доли веществ задачи Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества