Содержание
- 2. Цель урока: 1. Познакомить учащихся с новым классом неорганических соединений – основаниями. 2. Рассмотреть классификацию, состав
- 3. 4. Приведите формулы: воды, углекислого газа, негашеной извести, хлороводорода. Вопросы 2. Что такое оксиды? 3. В
- 4. Выпишите отдельно оксиды металлов и оксиды неметаллов и дайте им название. Na2O, H2O, CaCl2, NO, BaO,
- 5. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких
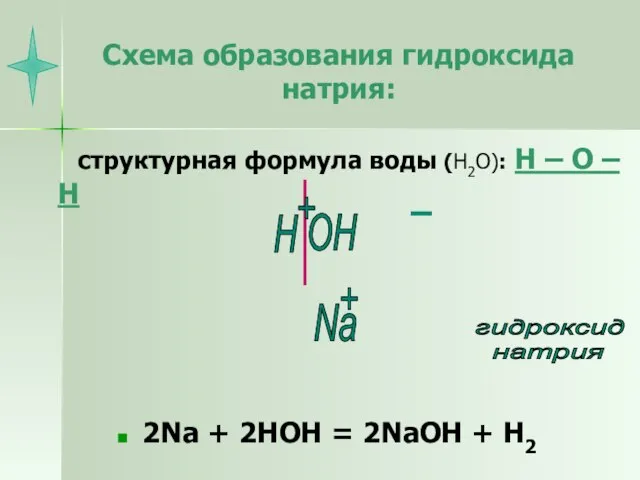
- 6. Схема образования гидроксида натрия: структурная формула воды (Н2О): Н – О – Н 2Na + 2HOH
- 7. Оксидам металла соответствуют основания: Составьте основания из оксидов: ZnO, Li2O, MgO. Попробуйте самостоятельно составить оксиды из
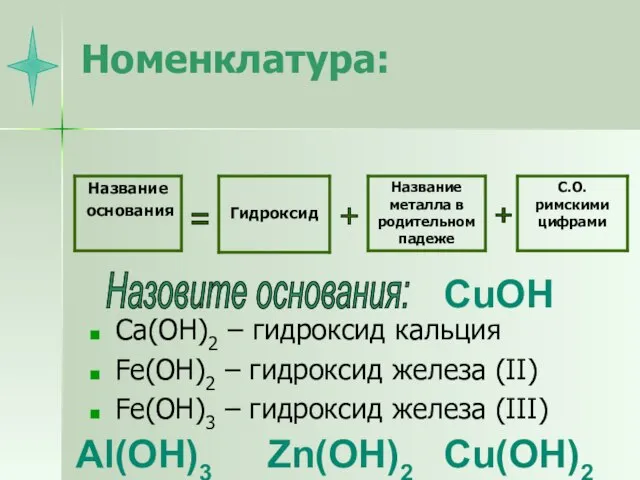
- 8. Номенклатура: Ca(OH)2 – гидроксид кальция Fe(OH)2 – гидроксид железа (II) Fe(OH)3 – гидроксид железа (III) =
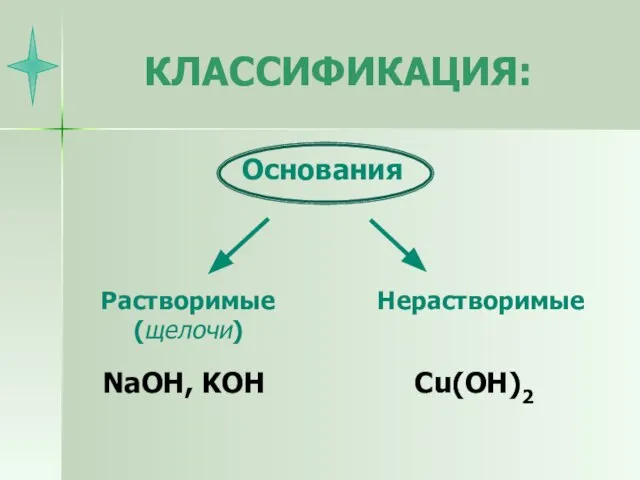
- 9. КЛАССИФИКАЦИЯ: NaOH, KOH Cu(OH)2
- 10. Закрепление 1. Что такое основание? 2. Какими по растворимости бывают основания? 3. Каким оксидам соответствуют основания?
- 11. Домашнее задание: § 19 Упр. 2 - 4
- 13. Скачать презентацию







 Алкадиены. Физические свойства
Алкадиены. Физические свойства Способы разделения смесей. Урок в 8 классе
Способы разделения смесей. Урок в 8 классе Применение муравьиного спирта
Применение муравьиного спирта Алкены. Строение
Алкены. Строение Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Наполнители для пластмасс
Наполнители для пластмасс Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Электролитическая диссоциация
Электролитическая диссоциация Презентация на тему Природные источники углеводородов
Презентация на тему Природные источники углеводородов  Металлы в организме человека
Металлы в организме человека Основания. Структурная формула
Основания. Структурная формула Угольная кислота и ее соли
Угольная кислота и ее соли Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Инертные газы и перспективы их применения
Инертные газы и перспективы их применения Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Teksta uzdevumi (1)
Teksta uzdevumi (1) Мышьяк. История. Нахождение в природе
Мышьяк. История. Нахождение в природе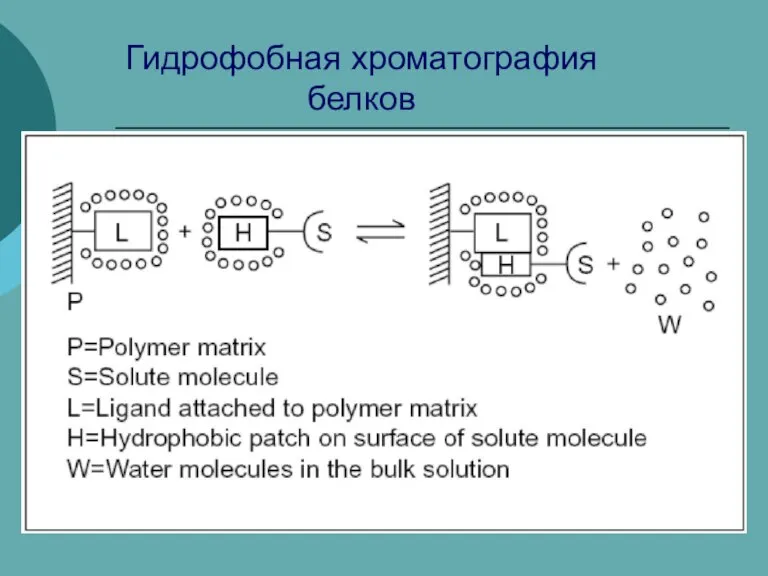 Гидрофобная хроматография белков
Гидрофобная хроматография белков агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Классификация химических реакций по различным основаниям
Классификация химических реакций по различным основаниям Презентация на тему Полимеры
Презентация на тему Полимеры  АРЕНЫ
АРЕНЫ Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Углеводороды
Углеводороды Минерал гранат
Минерал гранат Классификация химических реакций
Классификация химических реакций Хімічна промисловість
Хімічна промисловість Неорганические основания
Неорганические основания