Содержание
- 2. Способы получения оксидов 1) Взаимодействие простых веществ с кислородом. S + O2—› SO2 4Al + 3O2
- 3. Способы получения оксидов 4) Термическое разложение Нерастворимых оснований Cu(OН)2=CuО + H2O CaCO3 = CaO + CO2
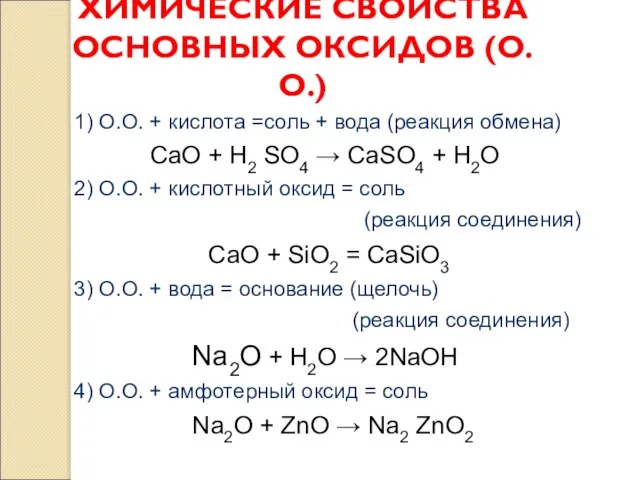
- 4. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO +
- 5. Химические свойства кислотных оксидов (К.О.) 1) К.О. + основание = соль + вода (реакция обмена) CO2
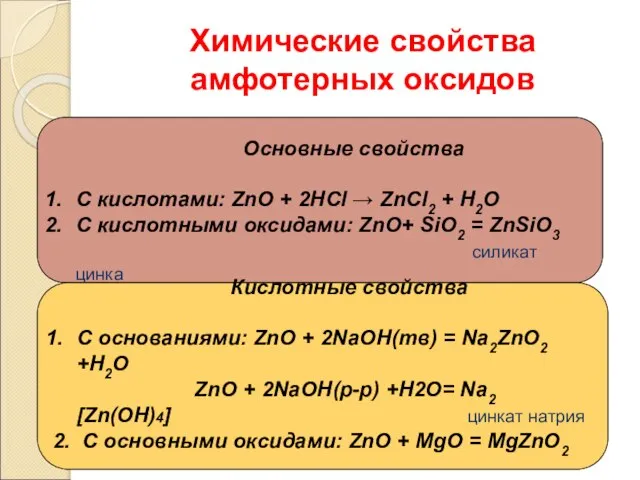
- 6. Химические свойства амфотерных оксидов Основные свойства С кислотами: ZnO + 2НСl → ZnСl2 + Н2О С
- 7. Способы получения растворимых оснований (щелочей) 1. Взаимодействие щелочных и щелочно-земельных металлов их оксидов с водой 2Na
- 8. Способы получения нерастворимых оснований 2. Взаимодействие раствора щелочи с раствором соли 3NaOH + АlCl3 = Al(OH)3
- 9. Способы получения амфотерных гидроксидов Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента AlCl3 + NаOH
- 10. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый Химические
- 11. 2. Взаимодействуют со всеми кислотами (реакция нейтрализации) NaOH + HCl → NaCl + H2O 3. Взаимодействуют
- 12. 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H2O → Na2SiO3 +
- 13. Химические свойства нерастворимых оснований 1. Взаимодействуют с кислотами (реакция нейтрализации) Fe(OH) 2 ↓+ H2SO4 → FeSO4
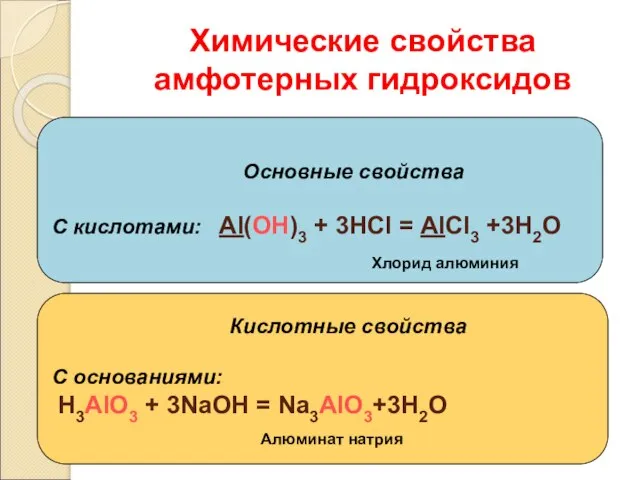
- 14. Химические свойства амфотерных гидроксидов Основные свойства С кислотами: Al(OH)3 + 3HCl = AlCl3 +3H2O Кислотные свойства
- 15. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой SO3 + H2O = H2SO4; CO2 +
- 16. Типичные реакции кислот 1. Кислота + основание = соль + вода H2SO4 +2 NaOH = Na2SO4
- 17. Типичные реакции кислот 3. Кислота + металл = водород + соль 2HCL +Zn = ZnCL2 +
- 18. Способы получения солей:
- 19. 6. Кислотный оксид с основанием CO2 + Ca(OH)2 → CaCO3↓ + H2O 7. Кислота с солью
- 20. Химические свойства солей: Более активный металл вытесняет менее активный из его соли. Zn + СuCl2 =
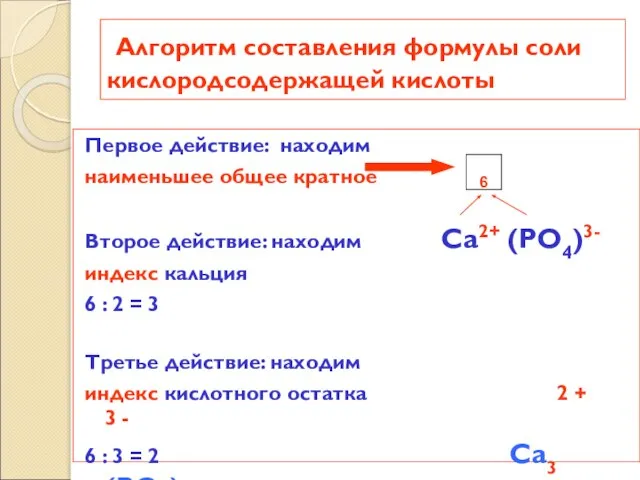
- 21. Алгоритм составления формулы соли кислородсодержащей кислоты Первое действие: находим наименьшее общее кратное Второе действие: находим Ca2+
- 22. Генетическая связь Связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого
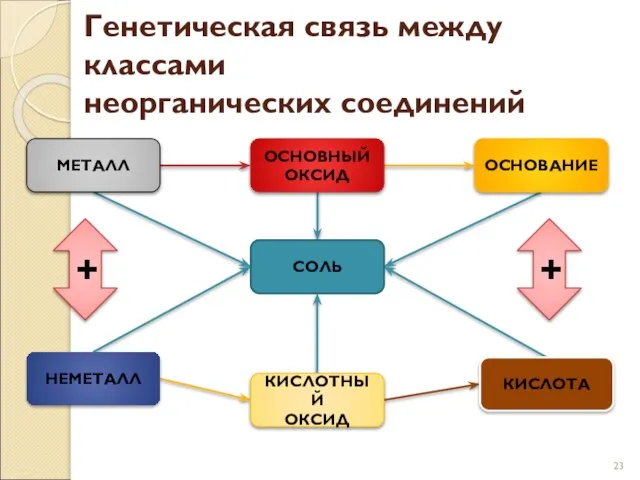
- 23. Генетическая связь между классами неорганических соединений МЕТАЛЛ ОСНОВНЫЙ ОКСИД ОСНОВАНИЕ СОЛЬ НЕМЕТАЛЛ КИСЛОТНЫЙ ОКСИД КИСЛОТА +
- 24. Генетическая связь отражается в генетических рядах. В состав любого генетического ряда входят вещества различных классов неорганических
- 25. Генетический ряд неметалла отражает такие превращения: Неметалл→ Кислотный оксид →Кислота → Соль. Уравнения реакций к генетическому
- 26. Задание для самостоятельной подготовки Составить уравнения реакций к генетическому ряду углерода C → CO2 → H2CO3
- 27. 2. Гидролиз
- 28. Типы солей: соли, образованные сильными основаниями и кислотами: KCl, KNO3, Nа2SO4, KI, Ca(NO3)2 не гидролизуются, рН
- 29. К Н2О 3. сильным основанием и слабой кислотой CH3COONa, KCN, Na2CO3, Na2SO3, Na2S, K3PO4 гидролизуются по
- 30. 4. слабым основанием и слабой кислотой CH3COONH4, NH4CN, (NH4)2S, Al2S3, (NH4)2SiO3 наиболее гидролизованы, рН ~ 7
- 31. Задание 1. 4 3 NH4+ + NO3- диссоциация NH NO гидролиз NH4NO3 + H2O NH OH
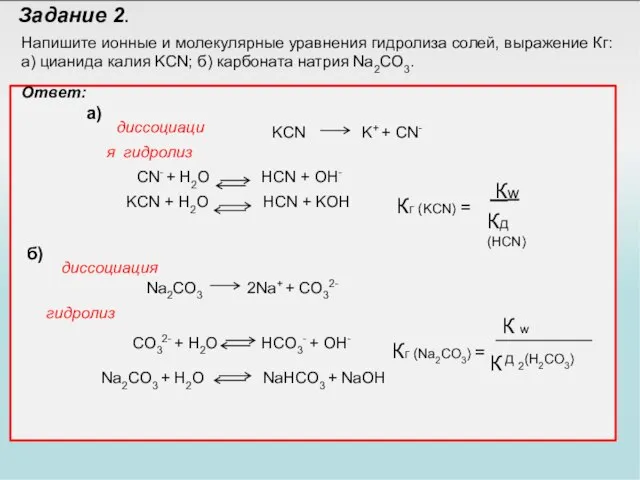
- 32. Задание 2. Напишите ионные и молекулярные уравнения гидролиза солей, выражение Кг: а) цианида калия KCN; б)
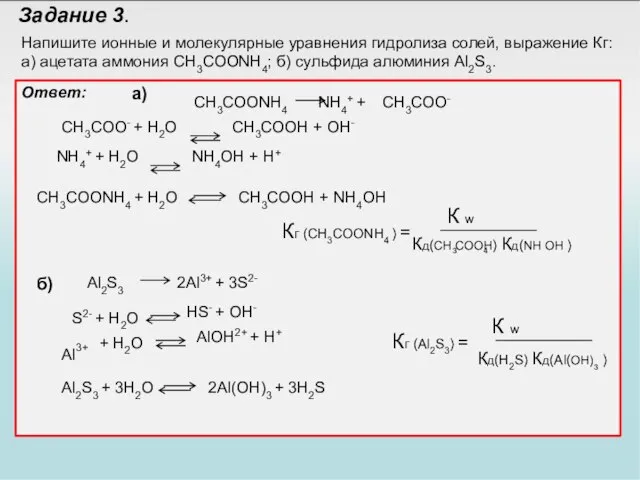
- 33. Задание 3. Напишите ионные и молекулярные уравнения гидролиза солей, выражение Кг: а) ацетата аммония CH3COONH4; б)
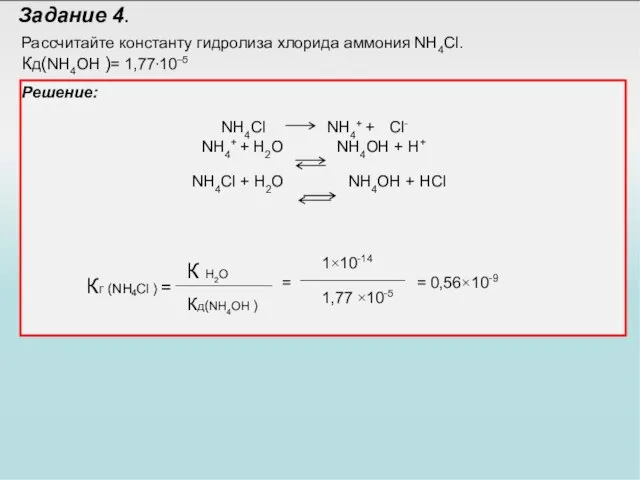
- 34. Задание 4. Рассчитайте константу гидролиза хлорида аммония NH4Cl. Кд(NH4OH )= 1,77⋅10–5 Решение: NH4Cl NH4+ + H2O
- 35. Закон разбавления Оствальда для случая гидролиза: Кг = CM×h2 1 – h При h Из закона
- 37. Скачать презентацию


























 Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Классификация органических веществ
Классификация органических веществ Типы химических реакций
Типы химических реакций Презентация по химии на тему _Закон постоянства со
Презентация по химии на тему _Закон постоянства со Азот, соединения азота
Азот, соединения азота Силикатная промышленность
Силикатная промышленность Морфологія та походження мінералів. Елементи кристалографії
Морфологія та походження мінералів. Елементи кристалографії Фосфор и его соединения. Открытие фосфора
Фосфор и его соединения. Открытие фосфора Характеристика галогенов
Характеристика галогенов Гальванические элементы
Гальванические элементы Методы активации карбоксильной группы
Методы активации карбоксильной группы Химические свойства алканов. Алканы
Химические свойства алканов. Алканы Основные классы неорганических соединений. Мы едем, едем, едем…
Основные классы неорганических соединений. Мы едем, едем, едем… Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами
Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами  Отчет по ПП 03.01. Лаборант химического анализа
Отчет по ПП 03.01. Лаборант химического анализа Круговорот азота в природе
Круговорот азота в природе Типичные реакции кислот
Типичные реакции кислот Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов
Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов Химический элемент натрий
Химический элемент натрий Процессы растворения твёрдых веществ
Процессы растворения твёрдых веществ Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Electrochemical properties of arylsilanes
Electrochemical properties of arylsilanes Ионные уравнения. Кислоты, их классификация. 8 класс
Ионные уравнения. Кислоты, их классификация. 8 класс Определение волокнистого состава хлопчатобумажных тканей. Практическая работа
Определение волокнистого состава хлопчатобумажных тканей. Практическая работа Условия среды, вызывающие коррозию металла
Условия среды, вызывающие коррозию металла Твердые электролиты
Твердые электролиты Дисперсные системы
Дисперсные системы 3bc28ca0711047a6880d20a6763f17db
3bc28ca0711047a6880d20a6763f17db