Содержание
- 2. Цель урока Образовательная: изучение химических свойств алканов, опираясь на их строение. Развивающая: продолжить формирование умения составлять
- 3. Задачи урока Изучить важнейшие химические свойства алканов и показать их зависимость от особенностей строения предельных углеводородов.
- 4. Химические свойства алканов Горение При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду
- 5. Химические свойства алканов Реакции замещения - это реакции алканов, идущих с разрывом С_Н связей. Давыдова Н.Г.
- 6. Галогенирование алканов СН4 + Cl2hv CH3Cl + HCl Хлорметан, или Хлористый метил СН3 Cl – газ,
- 7. Галогенирование алканов СН3Cl + Cl2 hv CH2Cl2 + HCl Дихлорметан, или хлористый метилен СН2 Cl2 –
- 8. Галогенирование алканов СН2Cl2 + Cl2 hv CHCl3 + HCl Трихлорметан или хлороформ СН Cl3 – хлороформ,
- 9. Галогенирование алканов СНCl3 + Cl2 hv CCl4 + HCl Тетрахлорметан, (четыреххлористый углерод) С Cl4 - применяется
- 10. Нитрование. При нагревании алканов до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования
- 11. Изомеризация Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с
- 12. Реакции разложения При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами
- 13. Крекинг- заводы Давыдова Н.Г.
- 14. Пиролиз При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды
- 15. Дегидрирование При пропускании нагретого алкана над платиновым или никелевым катализатором может отщепиться водород. Этот процесс называется
- 16. Конверсия. СН4+Н2O CO+3H2 Так называют взаимодействия алканов, из которых чаще всего используют природный газ с парами
- 17. Проверь себя В какие реакции вступают алканы? Выберите правильные ответы Давыдова Н.Г. верно верно неверно неверно
- 18. Знаешь ли ты ученых-органиков? Кто из учёных по словам соотечественников сумел оживить «мертвецов»? Давыдова Н.Г. неверно
- 19. Творческое задание По желанию можно выполнить одно из двух заданий: 1. Составить генетическую цепь, используя полученные
- 21. Скачать презентацию


















 Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Презентация на тему Лайнус Полинг
Презентация на тему Лайнус Полинг  Центробежное осаждение
Центробежное осаждение Структура, фазовый состав и спектрально-люминесцентные свойства твердых растворов La1-xNdxGa0,5Sb1,5O6
Структура, фазовый состав и спектрально-люминесцентные свойства твердых растворов La1-xNdxGa0,5Sb1,5O6 Биогаз. Технология производства
Биогаз. Технология производства Степень окисления
Степень окисления Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни
Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни  Гликолиз. Глюконеогенез. Пентозофосфатный путь
Гликолиз. Глюконеогенез. Пентозофосфатный путь Модульная технология на уроках химии
Модульная технология на уроках химии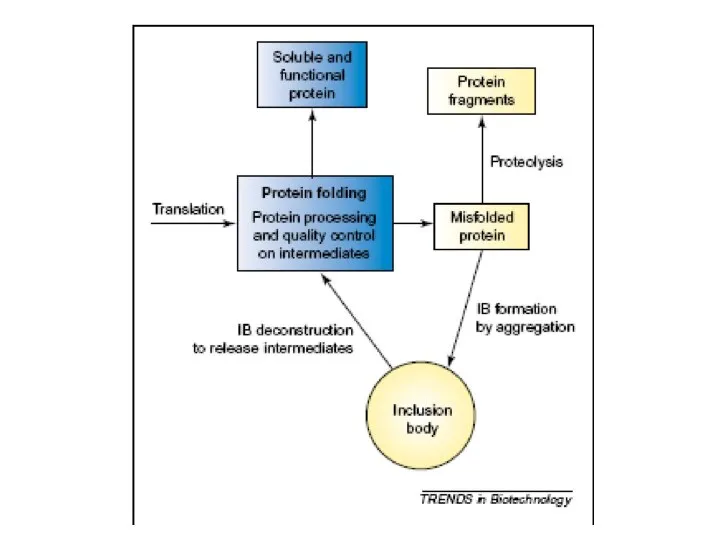 Рефолдинг миниантител
Рефолдинг миниантител Кроссворд по теме Металлы
Кроссворд по теме Металлы Тест: Азот
Тест: Азот Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Ионные уравнения
Ионные уравнения Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Ортофосфорная кислота
Ортофосфорная кислота Комментарии к выполненным заданиям по темам Алканы и Алкены. 9 класс
Комментарии к выполненным заданиям по темам Алканы и Алкены. 9 класс Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Свойства растворов электролитов
Свойства растворов электролитов Атомы, молекулы и ионы
Атомы, молекулы и ионы Удивительный мир химических задач
Удивительный мир химических задач Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Вода… Химические названия
Вода… Химические названия Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Общая химия, понятия
Общая химия, понятия Вещество и тело. Чистые вещества и смеси
Вещество и тело. Чистые вещества и смеси Классы неорганических веществ
Классы неорганических веществ