Содержание
- 2. Химические свойства оснований обусловлены наличием у них гидроксо-ионов ОН- .
- 3. Взаимодействие оснований
- 4. Взаимодействие оснований и кислот Основание + кислота Соль + вода Реакция обмена
- 5. Взаимодействие оснований и кислот
- 6. H2SO4 + 2NaOH = Na2SO4 + 2H2O Взаимодействие оснований и кислот Н+ + ОН- = H2O
- 7. Взаимодействие щёлочи и оксидов неметаллов Щёлочь + оксид неметалла Соль + вода
- 8. Взаимодействие щёлочи и оксидов неметаллов Реакция обмена
- 9. Взаимодействие щёлочи и оксидов неметаллов
- 10. Взаимодействие щёлочи и оксидов неметаллов Са(ОН)2 + СО2 = СаСО3↓ + Н2О соль (осадок) вода
- 11. Взаимодействие щёлочи и соли Са(ОН)2 + СО2 = СаСО3↓ + Н2О соль (осадок) вода
- 12. Взаимодействие щёлочи и соли Протекание реакции взаимодействия щелочей и солей происходит только в случае образования нерастворимого
- 13. Взаимодействие щёлочи и соли FeСl2
- 14. Взаимодействие щёлочи и соли 2NaOH + FeCl2 = 2NaCl + Fe(OH)2↓ хлорид натрия гидроксид железа 2OH-
- 15. Ba(OH)2 Взаимодействие щёлочи и соли
- 16. Взаимодействие щёлочи и соли Ba(OH)2 + 2NH4Cl = BaCl2 + 2NH3↑ + 2Н2О хлорид бария аммиак
- 17. ZnCl2 Взаимодействие щёлочи и соли
- 18. Взаимодействие щёлочи и соли
- 19. Взаимодействие щёлочи и соли 2NaOH + ZnCl2 = 2NaCl + Zn(OH)2↓ 2OH- + Zn2+ = Zn(OH)2↓
- 21. Скачать презентацию

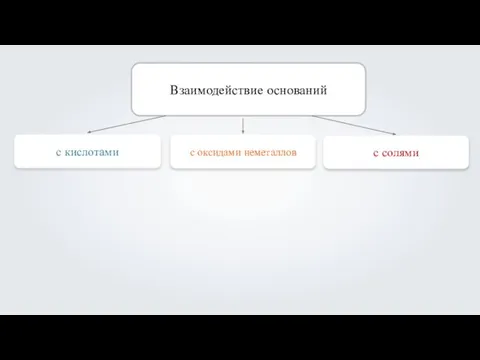

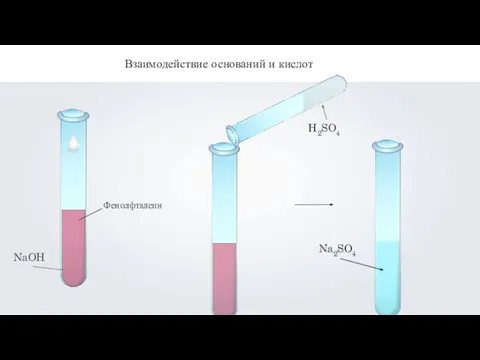







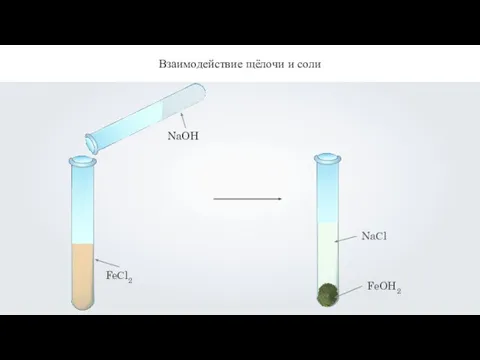

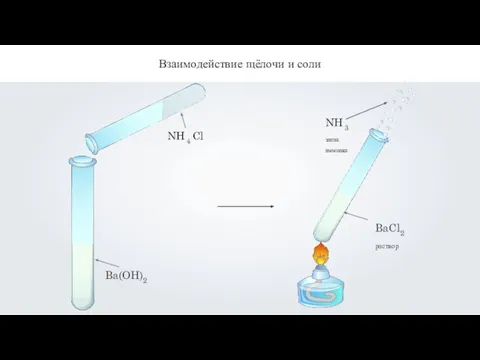

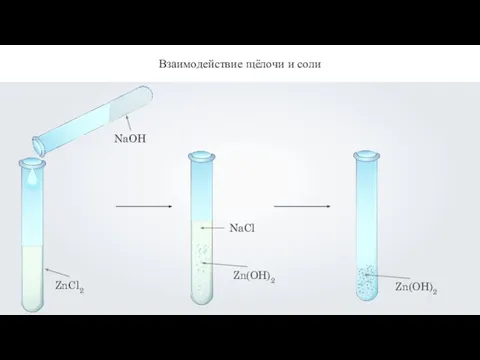


 Диаграмма состояния системы железо - углерод
Диаграмма состояния системы железо - углерод Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы Кислоты органические и неорганически
Кислоты органические и неорганически Химические реакции
Химические реакции Кремнийорганические мономеры: Органохлорсиланы
Кремнийорганические мономеры: Органохлорсиланы Алкены
Алкены Физические и химические свойства алкенов
Физические и химические свойства алкенов Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека 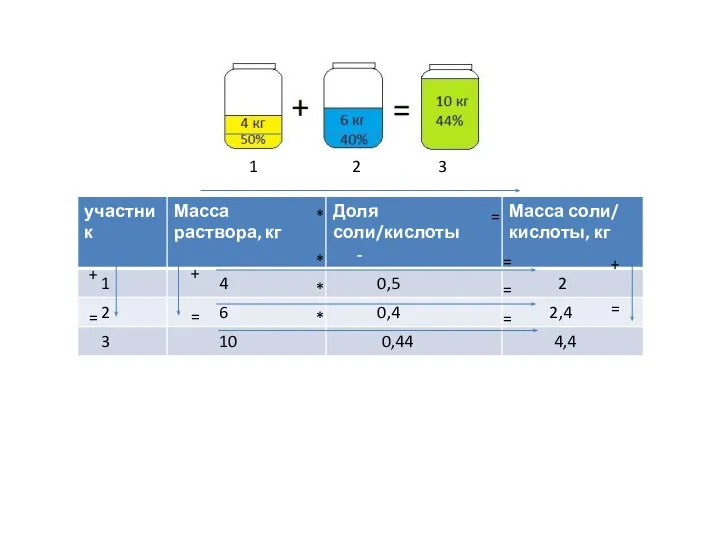 Концентрация растворов
Концентрация растворов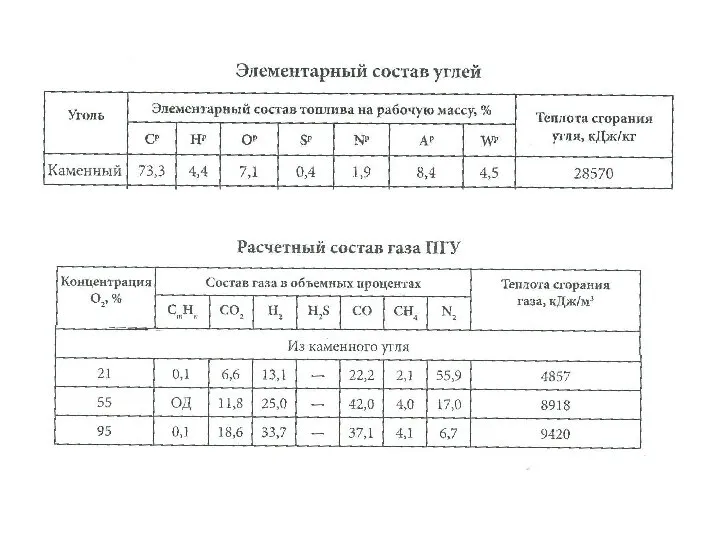 Элементарный состав углей
Элементарный состав углей Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Презентация на тему Самородки 9 класс
Презентация на тему Самородки 9 класс  Отжиг сталей (отжиг 2-го рода) Лекция 2
Отжиг сталей (отжиг 2-го рода) Лекция 2 Характеристика кислорода и серы
Характеристика кислорода и серы Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Радиоакивные металлы
Радиоакивные металлы Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Презентация на тему Бензол
Презентация на тему Бензол  Основания
Основания Процесс диссоциации
Процесс диссоциации Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена
Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена