Содержание
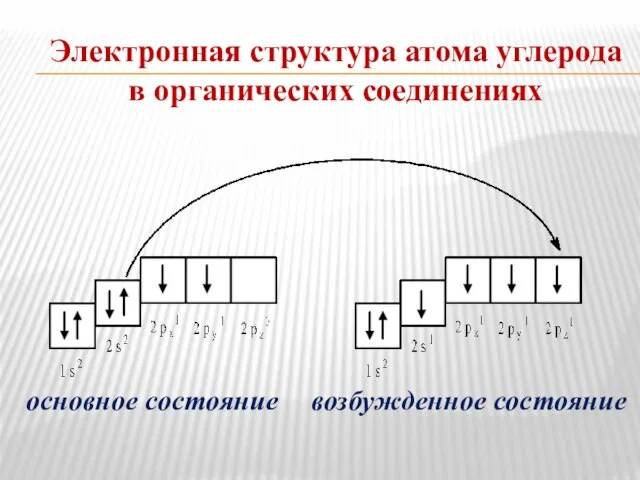
- 2. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
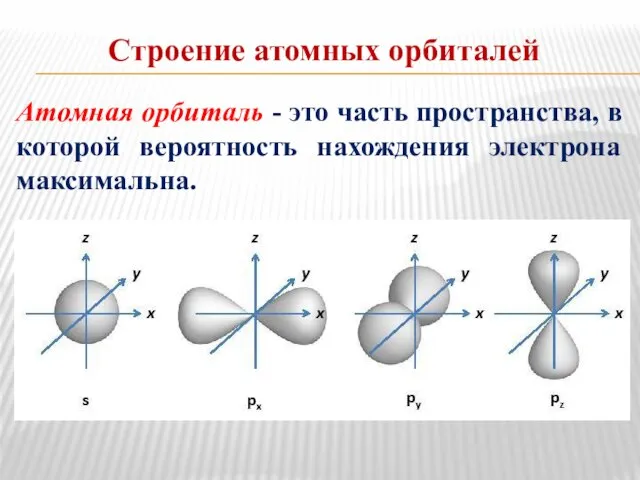
- 3. Строение атомных орбиталей Атомная орбиталь - это часть пространства, в которой вероятность нахождения электрона максимальна.
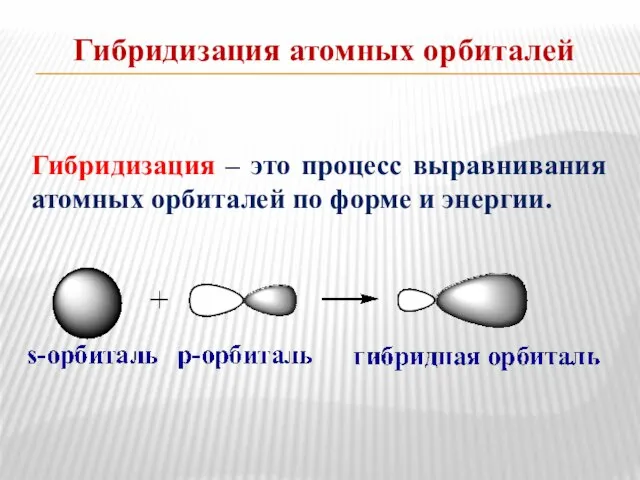
- 4. Гибридизация атомных орбиталей Гибридизация – это процесс выравнивания атомных орбиталей по форме и энергии.
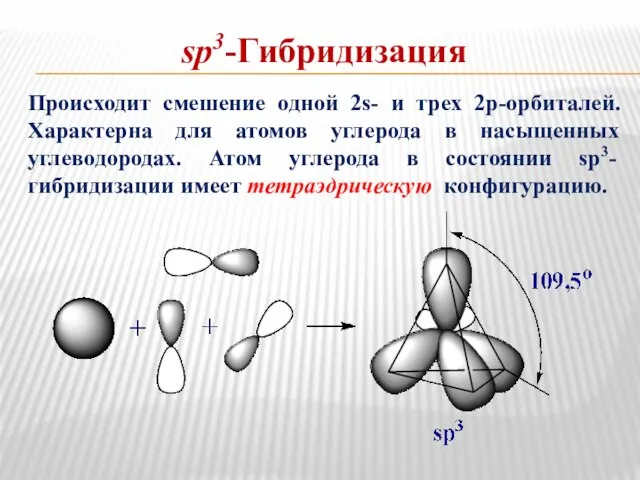
- 5. sp3-Гибридизация Происходит смешение одной 2s- и трех 2р-орбиталей. Характерна для атомов углерода в насыщенных углеводородах. Атом
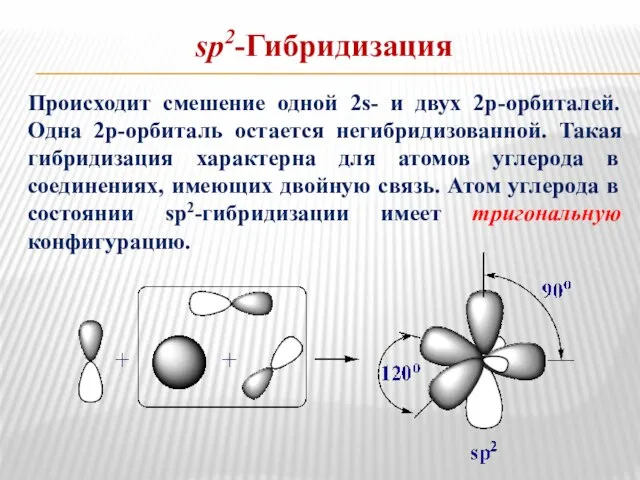
- 6. sp2-Гибридизация Происходит смешение одной 2s- и двух 2р-орбиталей. Одна 2р-орбиталь остается негибридизованной. Такая гибридизация характерна для
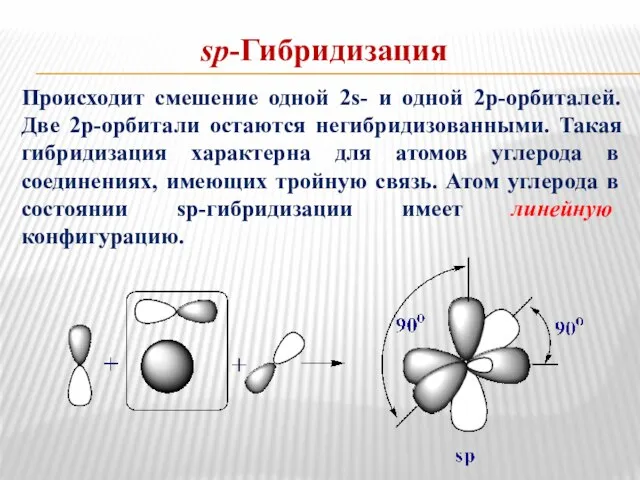
- 7. sp-Гибридизация Происходит смешение одной 2s- и одной 2р-орбиталей. Две 2р-орбитали остаются негибридизованными. Такая гибридизация характерна для
- 8. Химическая связь в органических молекулах В органических соединениях преимущественно встречаются ковалентные связи – химические связи, образованные
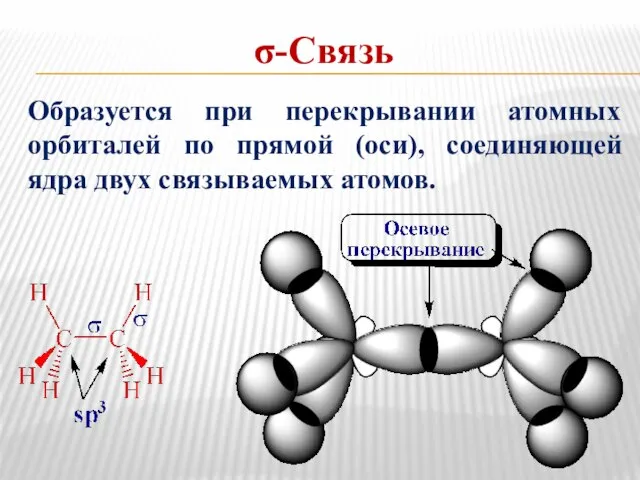
- 9. σ-Связь Образуется при перекрывании атомных орбиталей по прямой (оси), соединяющей ядра двух связываемых атомов.
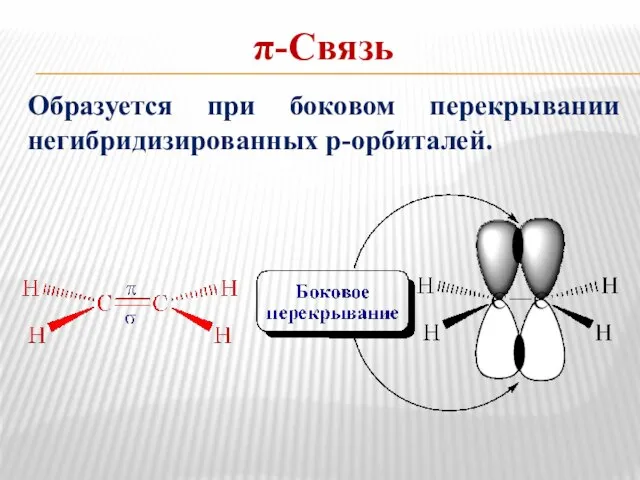
- 10. π-Связь Образуется при боковом перекрывании негибридизированных р-орбиталей.
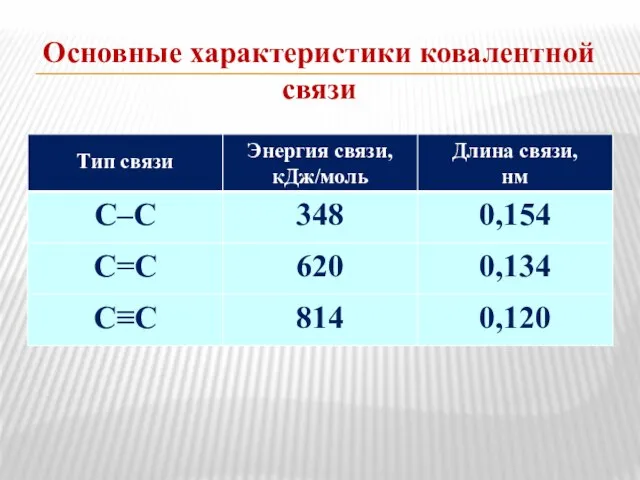
- 11. Основные характеристики ковалентной связи
- 12. Полярность ковалентной связи Электроотрицательность – это способность атома в молекуле притягивать электроны, участвующие в образовании химической
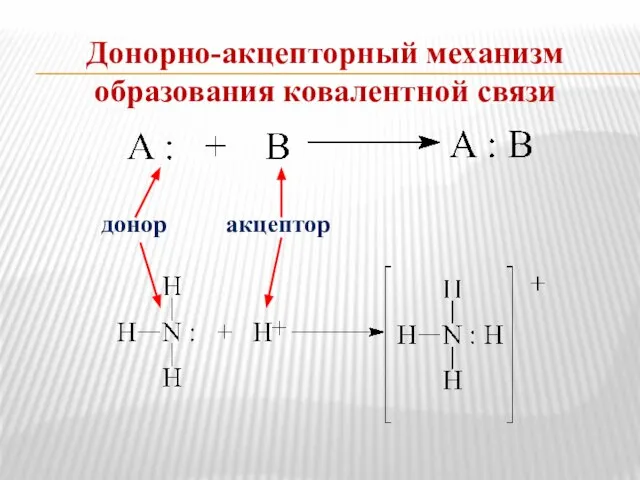
- 13. Донорно-акцепторный механизм образования ковалентной связи донор акцептор
- 14. Водородная связь Энергия водородной связи — 12,5 - 20 кДж/моль Характерна для органических соединений, имеющих атомы
- 15. Сопряжение Локализованная связь – это ковалентная связь, электронная пара которой находится в поле двух ядер и
- 16. Условия, необходимые для образования сопряженных систем Все атомы, участвующие в образовании сопряженной системы, находятся в sр2-гибридизации;
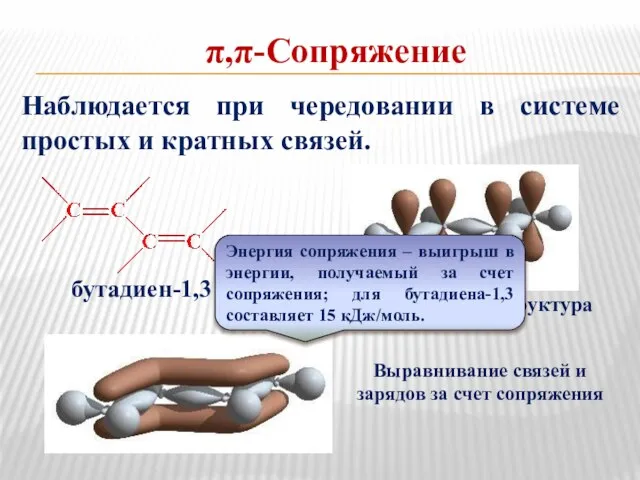
- 17. π,π-Сопряжение Наблюдается при чередовании в системе простых и кратных связей. Выравнивание связей и зарядов за счет
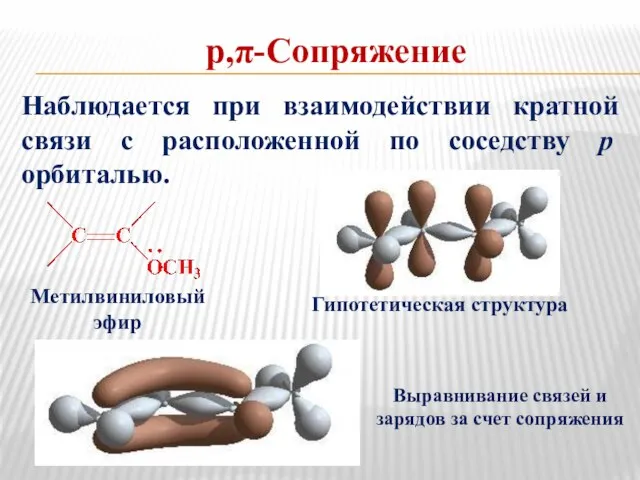
- 18. р,π-Сопряжение Наблюдается при взаимодействии кратной связи с расположенной по соседству рорбиталью. Метилвиниловый эфир Гипотетическая структура Выравнивание
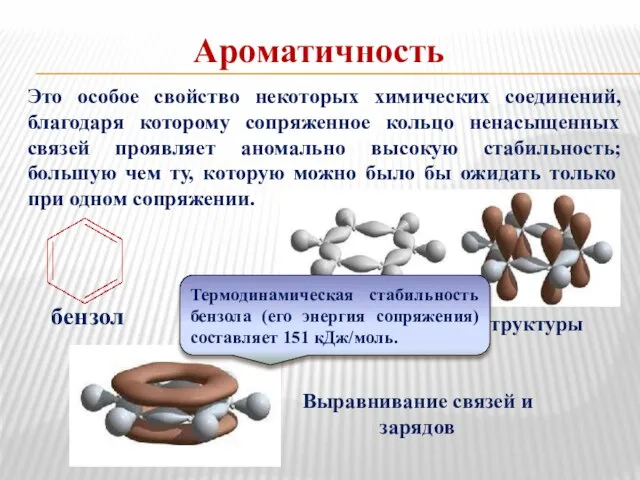
- 19. Ароматичность Это особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую
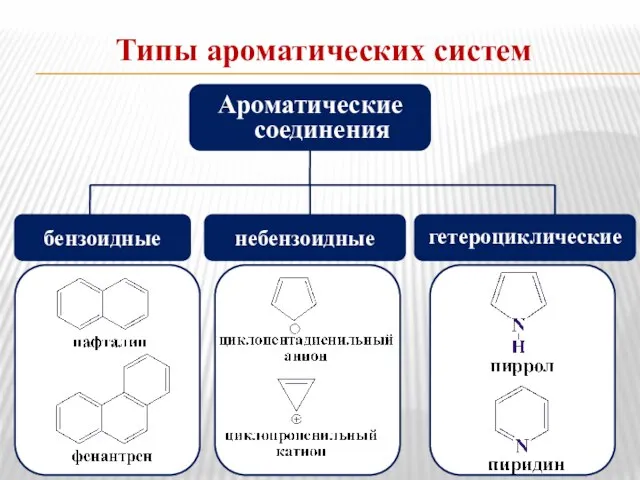
- 20. Типы ароматических систем Ароматические соединения бензоидные небензоидные гетероциклические
- 21. Критерии ароматичности
- 22. Взаимное влияние атомов в молекуле Взаимное влияние атомов в молекулах передается с помощью электронных и пространственных
- 23. Индуктивный эффект Индуктивный эффект (I) − передача электронного влияния заместителя в результате смещения электронов σ-связей. присутствует
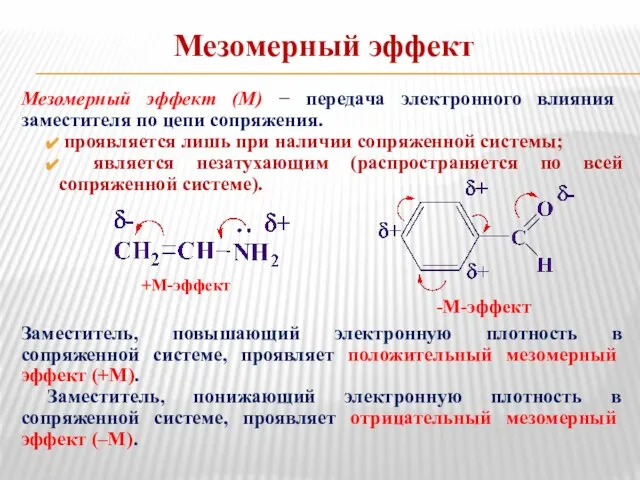
- 24. Мезомерный эффект Мезомерный эффект (М) − передача электронного влияния заместителя по цепи сопряжения. проявляется лишь при
- 26. Скачать презентацию








 Chimie bioorganique
Chimie bioorganique Формула любви
Формула любви Кислородные соединения углерода
Кислородные соединения углерода Классификация неорганических веществ
Классификация неорганических веществ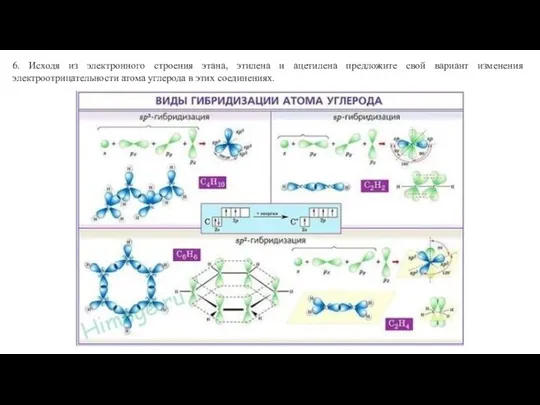 Виды гибридизации атома углерода
Виды гибридизации атома углерода Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Презентация на тему Углекислый газ CO2
Презентация на тему Углекислый газ CO2  Синтетические волокна
Синтетические волокна Лекция1Тов
Лекция1Тов АРЕНЫ
АРЕНЫ Всё – от песчинок малых планет до планет – из элементов состоит единых
Всё – от песчинок малых планет до планет – из элементов состоит единых Побочная подгруппа VIII группы
Побочная подгруппа VIII группы Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  bb85cf00b0d84614b17e8a6aa4be54a0
bb85cf00b0d84614b17e8a6aa4be54a0 Гальванический элемент
Гальванический элемент Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Физические и химические свойства азота
Физические и химические свойства азота ТЕСТ "Дисперсные системы"
ТЕСТ "Дисперсные системы" Презентация на тему Вещества и их свойства
Презентация на тему Вещества и их свойства  Парафины. Алканы
Парафины. Алканы Строение молекул. Метод валентных связей. Лекция 5
Строение молекул. Метод валентных связей. Лекция 5 Электролиз. Задания
Электролиз. Задания Вспомогательные средства для стирки
Вспомогательные средства для стирки Жиры
Жиры Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Электролитическая диссоциация
Электролитическая диссоциация Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Презентация на тему ИКТ на уроках химии
Презентация на тему ИКТ на уроках химии