Содержание
- 2. Какие общие способности (свойства) объединяют кислоты? 2. Почему у всех кислот есть общие (характерные) свойства? Подтвердите
- 3. Общие свойства кислот: 1. Реакция на индикатор; 2. взаимодействие с металлами; 3. взаимодействие с оксидами металлов;
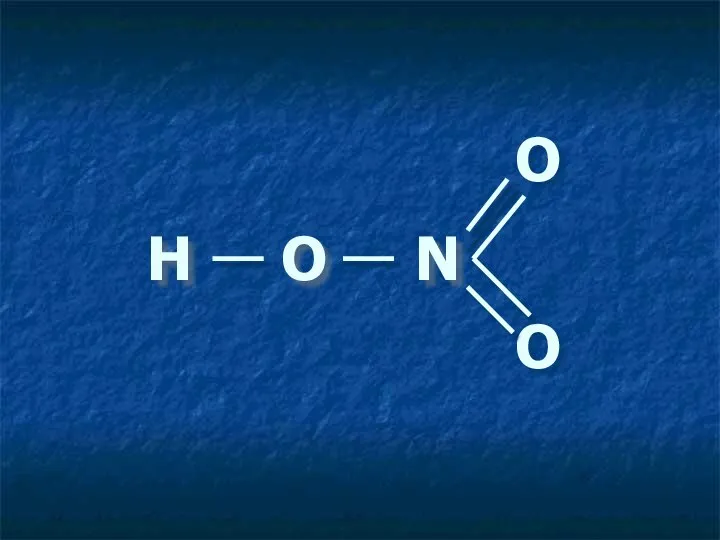
- 4. Н О N О О
- 5. АЗОТНАЯ КИСЛОТА КАК ОКИСЛИТЕЛЬ. ПОЛУЧЕНИЕ АЗОТНОЙ КИСЛОТЫ ИЗ АММИАКА. План урока. 1. Особенности взаимодействия азотной кислоты
- 6. Цели урока. 1. Знать особенности взаимодействия азотной кислоты разной концентрации с металлами. 2. Уметь писать уравнения
- 7. Особенности строения азотной кислоты. 1 гр. –составьте формулы оксидов азота со с.о. +1,+2.. Охарактеризуйте их (стр.118).
- 8. Особенности строения азотной кислоты. 1. Соотнесите: с.о. атома азота формула оксида азота а) +1, б)+2, в)+3,
- 9. Ответы на вопросы теста. Вопрос 1. а) – 5), б) – 1), в) – 2), г)
- 10. Кислородные соединения азота. N2O – «веселящий газ», без цвета, несолеобразующий; NO – газ без цвета и
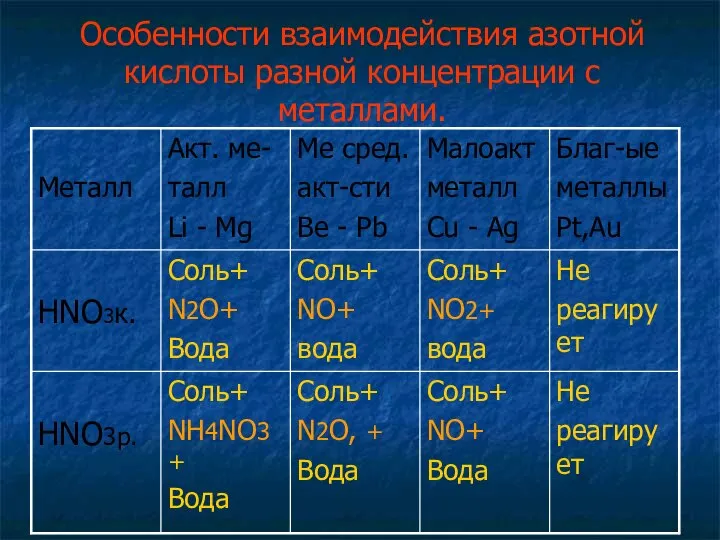
- 11. Особенности взаимодей- ствия азотной кислоты разной концентрации с металлами.
- 12. Лабораторный опыт. Взаимодействие конц. азотной кислоты с медью (Cu).
- 13. Лабораторный опыт. Взаимодействие конц. азотной кислоты с ртутью. (Hg).
- 14. Особенности взаимодействия азотной кислоты разной концентрации с металлами.
- 15. Конц. азотная кислота пассивирует металлы AL,Fe,Cr.
- 16. Как металлы с азотной кислотой воевали. В одной сказочной стране был город мастеров. Жили в нем
- 17. Герцогини Азотной и предупреждал металлы. И вот, настал первый день сражения. Индикатор сообщил, что войска противника
- 18. спехах. Но, он не устоял. А в воздухе появился токсичный газ без цвета и запаха. Опять
- 19. из чистого золота, сверкающих в лучах осеннего солнца, вышел в бой. Он доблестно сражался, ему даже
- 20. Как металлы азотную кислоту победили! 4Zn + 10HNO3(p.) = N2O + 4Zn(NO3)2 + + 5H2O; 3Cu
- 21. HNO3 конц. на холоде пассивирует металлы AL, Cr, Fe – они покрываются прочной оксидной пленкой и
- 22. Применение азотной кислоты.
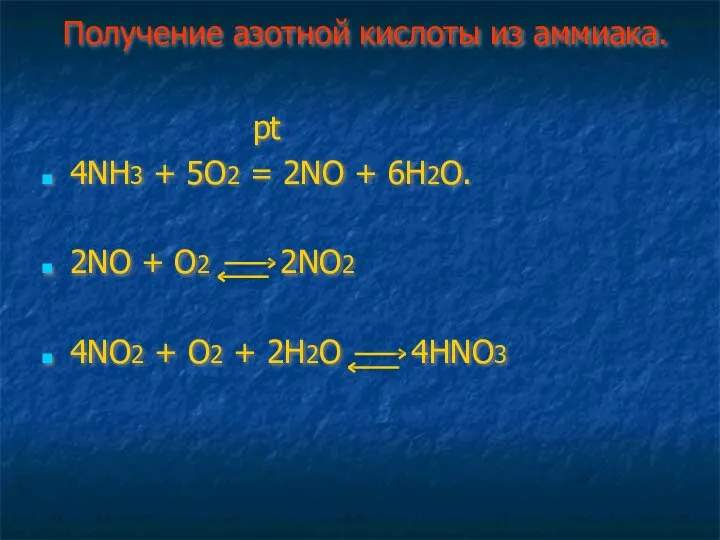
- 23. Получение азотной кислоты из аммиака 1 2 3 Аммак ---- ? ------ ? ------ азотная кислота
- 24. Получение азотной кислоты из аммиака. pt 4NH3 + 5O2 = 2NO + 6H2O. 2NO + O2
- 25. Выводы по теме урока. Какие особенности проявляет азотная кислота при взаимодействии с металлами? Какие продукты получаются
- 26. 1. Знать особенности взаимодействия азотной кислоты разной концентрации с металлами. 2. Уметь писать уравнения хим. реакций.
- 28. Скачать презентацию






















 Строение атома
Строение атома Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс Железо. Положение железа в ПСХЭ
Железо. Положение железа в ПСХЭ Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Диссоциация кислот, щелочей, солей
Диссоциация кислот, щелочей, солей Электролиз. Применение электролиза
Электролиз. Применение электролиза Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Тема: Неметаллы
Тема: Неметаллы Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Строение атома. История открытия атома
Строение атома. История открытия атома Радон (222Rn)
Радон (222Rn) Основания. Структурная формула
Основания. Структурная формула Опыт разработки учебно-методического комплекса Химия
Опыт разработки учебно-методического комплекса Химия Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Биогаз. Технология производства
Биогаз. Технология производства Неорганические окислители и восстановители
Неорганические окислители и восстановители Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр
Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр Валентность
Валентность Сложные эфиры
Сложные эфиры Основные понятия химической термодинамики
Основные понятия химической термодинамики Техника безопасности на уроках химии
Техника безопасности на уроках химии Кафедра общей и биоорганической химии
Кафедра общей и биоорганической химии Предмет органической химии
Предмет органической химии Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04)
Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04) Фосфор и его соединения. Открытие фосфора
Фосфор и его соединения. Открытие фосфора