Содержание
- 2. Классификация органических соединений
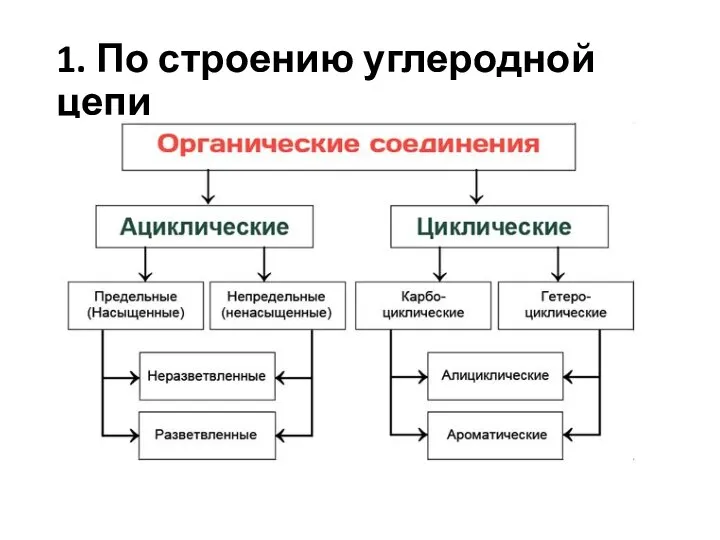
- 3. 1. По строению углеродной цепи
- 4. Алициклические соединения – соединения с открытой (незамкнутой) углеродной цепью. Эти соединения называются также алифатическими Среди ациклических
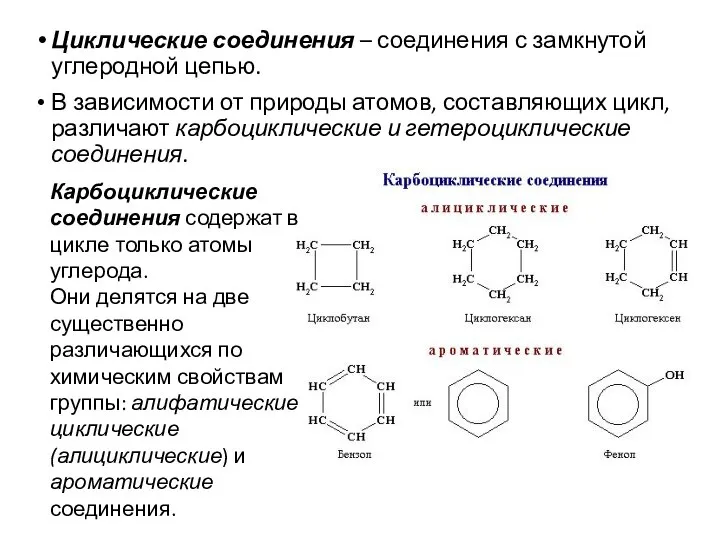
- 5. Циклические соединения – соединения с замкнутой углеродной цепью. В зависимости от природы атомов, составляющих цикл, различают
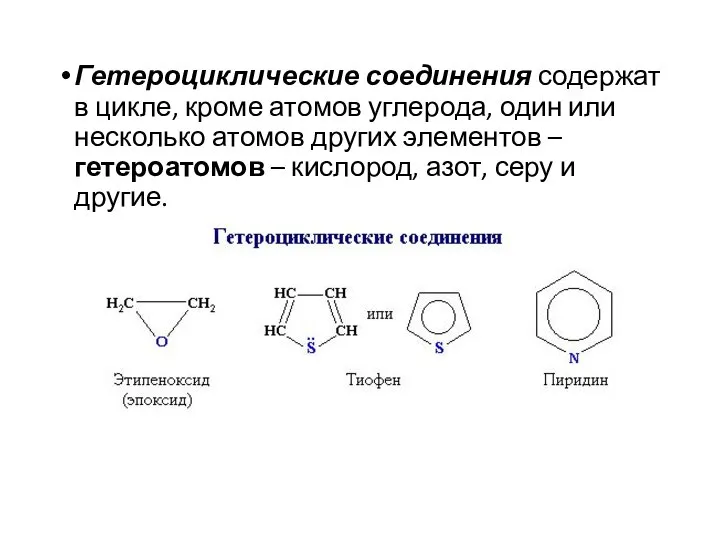
- 6. Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов
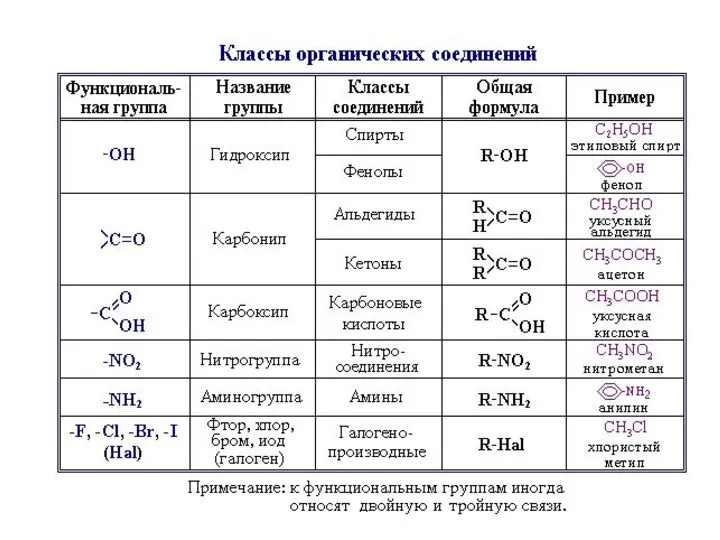
- 7. 2. По функциональным группам В каждом из типов углеродного скелета все соединения распределяются по классам в
- 9. Классификация органических реакций
- 10. Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и
- 11. 1. Классификация реакций по конечному результату В основе этой классификации лежит сопоставление числа, состава и строения
- 12. Реакции замещения Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную
- 13. Реакции присоединения В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в
- 14. Реакции отщепления В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества
- 15. Реакции изомеризации или перегруппировки В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от
- 16. Реакции окисления и восстановления Окислительно-восстановительные реакции - реакции, в ходе которых меняется степень окисления атомов, входящих
- 17. 2. Классификация реакций по числу частиц, участвующих в элементарной стадии По этому признаку все реакции можно
- 18. 3. Классификация реакций по механизму разрыва связей В зависимости от способа разрыва ковалентной связи в реагирующей
- 19. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
- 20. Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента. Нуклеофильные («любящие ядро») реагенты,
- 21. Изомерия органических соединений
- 22. Изомерия – это явление существования отличающихся по свойствам химических соединений с одинаковым качественным и количественным составом
- 23. 1. Структурная изомерия Структурные изомеры – это изомеры, имеющие разную структурную формулу, т. е. разный порядок
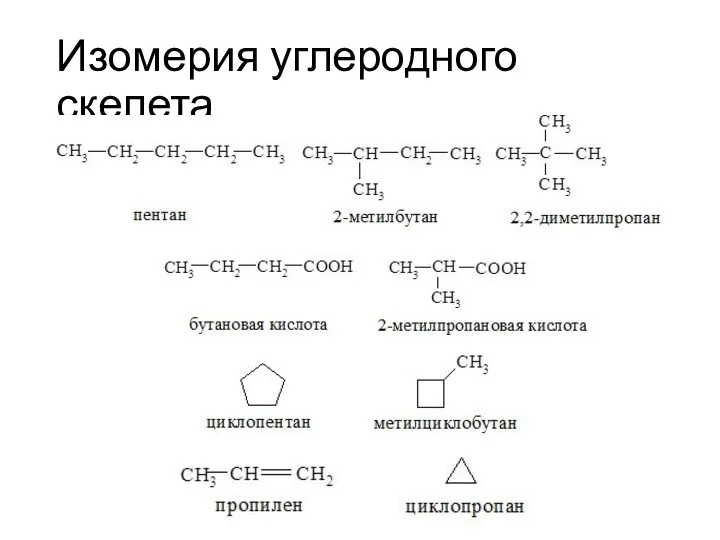
- 24. Изомерия углеродного скелета
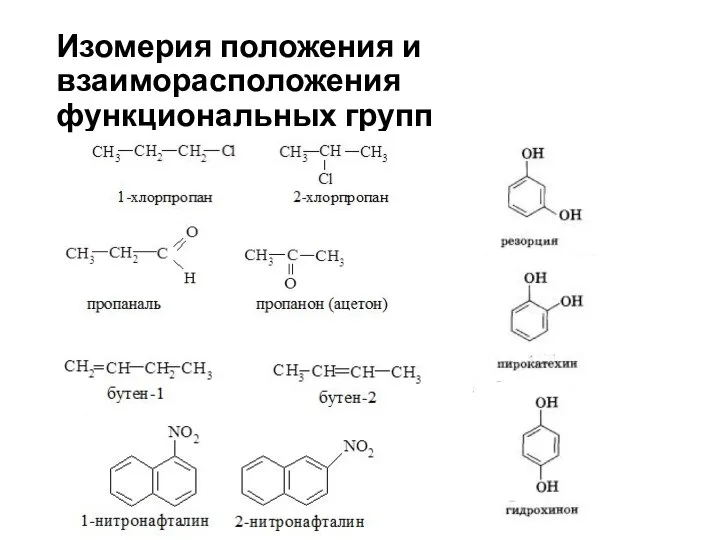
- 25. Изомерия положения и взаиморасположения функциональных групп
- 26. Метамерия Метамерами называются изомеры, отличающиеся величиной углеводородных радикалов у одного и того же многовалентного атома. В
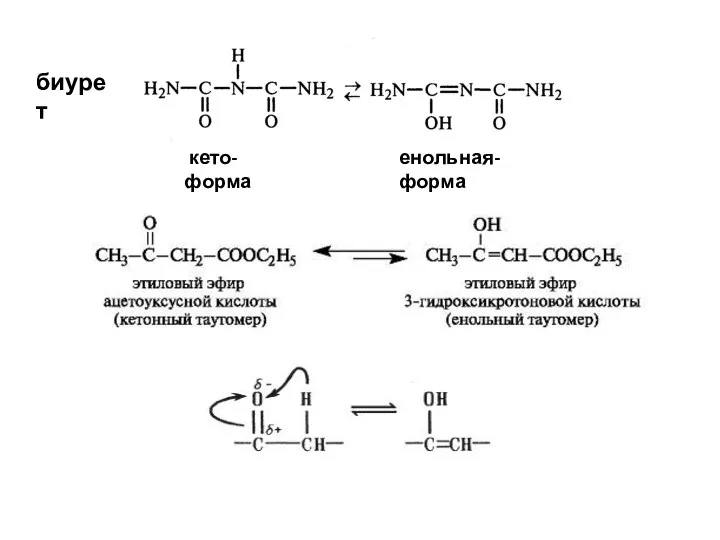
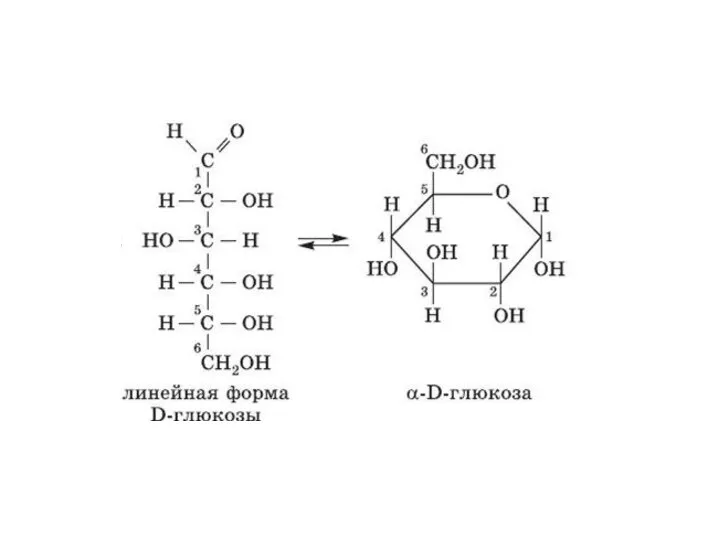
- 27. 2. Динамическая изомерия Таутомерия – явление равновесной динамической изомерии, при которой происходит быстрое обратимое самопроизвольное превращение
- 28. кето-форма енольная-форма биурет
- 30. 3. Пространственная изомерия Пространственные изомеры (стереоизомеры) – это вещества, имеющие одинаковую структурную формулу, т. е. одинаковый
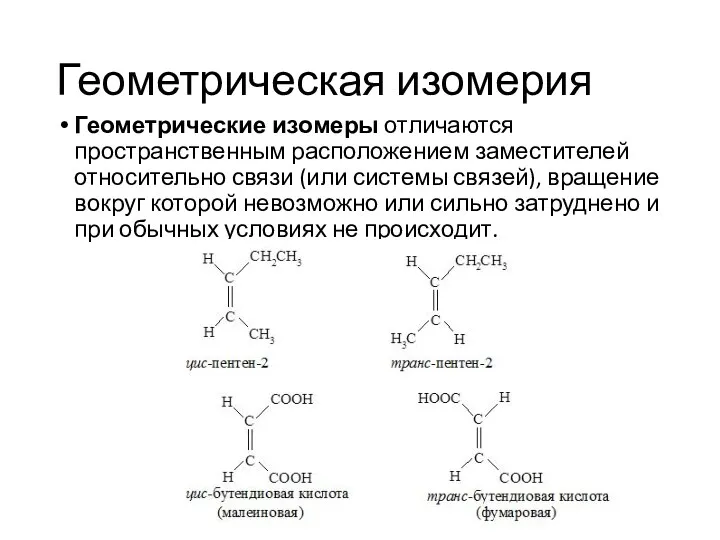
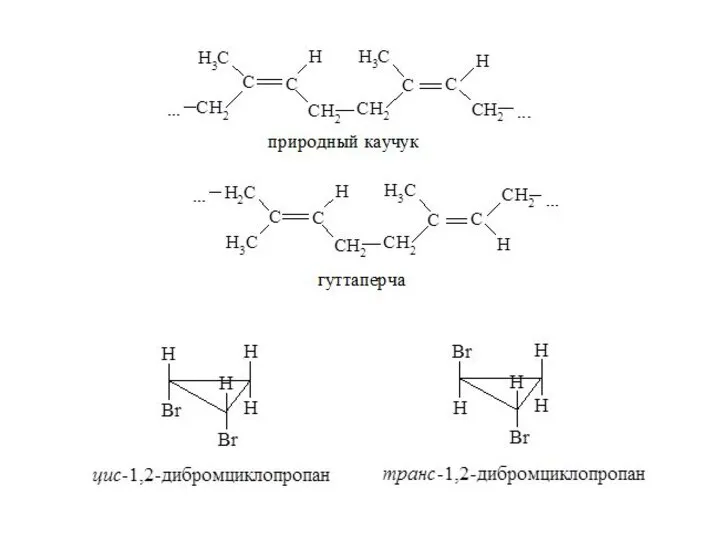
- 31. Геометрическая изомерия Геометрические изомеры отличаются пространственным расположением заместителей относительно связи (или системы связей), вращение вокруг которой
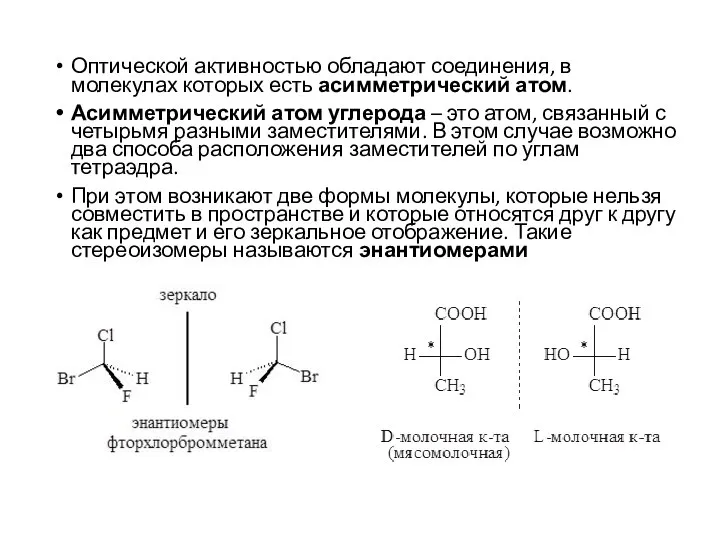
- 33. Оптическая изомерия В 1815 году французский физик Ж.Б. Био обнаружил, что некоторые природные органические вещества в
- 34. Оптической активностью обладают соединения, в молекулах которых есть асимметрический атом. Асимметрический атом углерода – это атом,
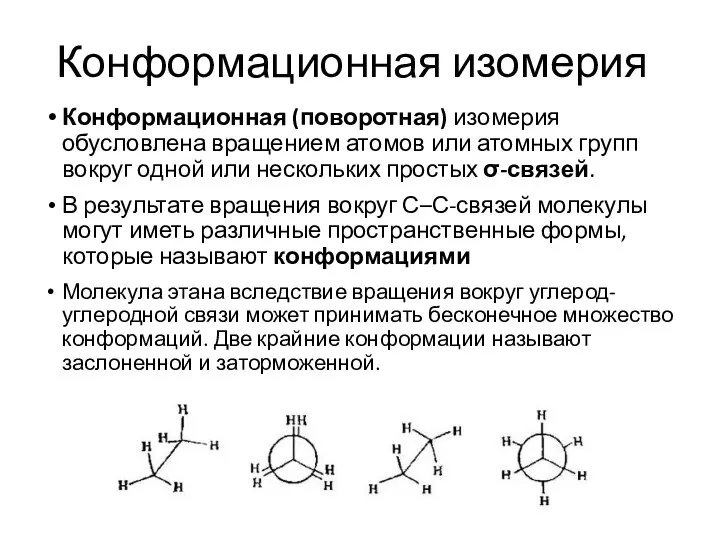
- 35. Конформационная изомерия Конформационная (поворотная) изомерия обусловлена вращением атомов или атомных групп вокруг одной или нескольких простых
- 37. Скачать презентацию






















 Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Сера
Сера Применение кислорода. Что же такое Кислород?
Применение кислорода. Что же такое Кислород? Производство азотных удобрений
Производство азотных удобрений Практическая работа №1. Определение содержания нитратов в овощах и фруктах
Практическая работа №1. Определение содержания нитратов в овощах и фруктах Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Электрохимия. Решение задач. ИДЗ 4
Электрохимия. Решение задач. ИДЗ 4 Комплексонометрия. Способы комплексонометрического титрования
Комплексонометрия. Способы комплексонометрического титрования Вспомогательные средства для стирки
Вспомогательные средства для стирки Вещества простые и сложные
Вещества простые и сложные Формирование и контроль остаточных напряжений, возникающих под действием различных технологических операций
Формирование и контроль остаточных напряжений, возникающих под действием различных технологических операций Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7
Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7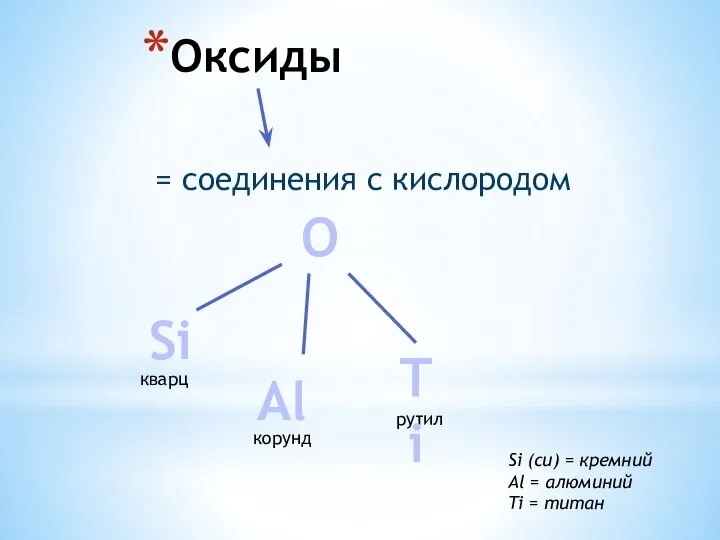 Оксиды. Кварц (SiO2). Корунд (Al2O3)
Оксиды. Кварц (SiO2). Корунд (Al2O3) Классификация методов переработки пластмасс
Классификация методов переработки пластмасс Презентация на тему Обобщение по типам химических реакций
Презентация на тему Обобщение по типам химических реакций  Качественная реакция на многоатомные спирты
Качественная реакция на многоатомные спирты Медь
Медь Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа Химический элемент Франций (Fr)
Химический элемент Франций (Fr) Солевые кристаллы
Солевые кристаллы Физика полимеров Ч1
Физика полимеров Ч1 kisloty
kisloty Ароматические углеводороды
Ароматические углеводороды Неорганосфера. Неметаллы
Неорганосфера. Неметаллы Реализация системно-деятельностного подхода совместно с компьютерными технологиями в преподавании химии
Реализация системно-деятельностного подхода совместно с компьютерными технологиями в преподавании химии Слабые и сильные электролиты
Слабые и сильные электролиты Общая характеристика VIIА-группы – Галогены
Общая характеристика VIIА-группы – Галогены