Содержание
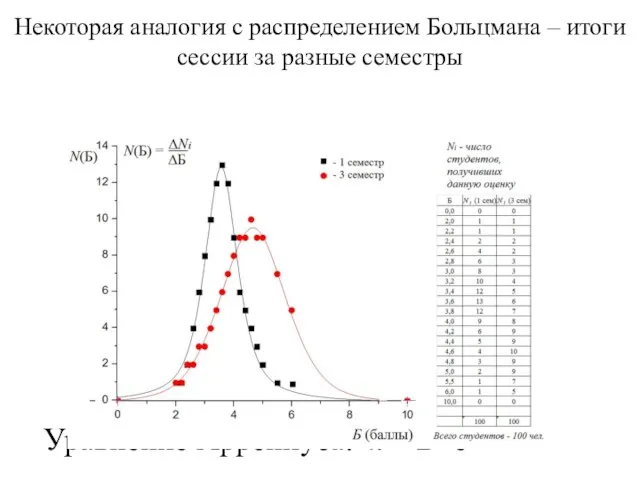
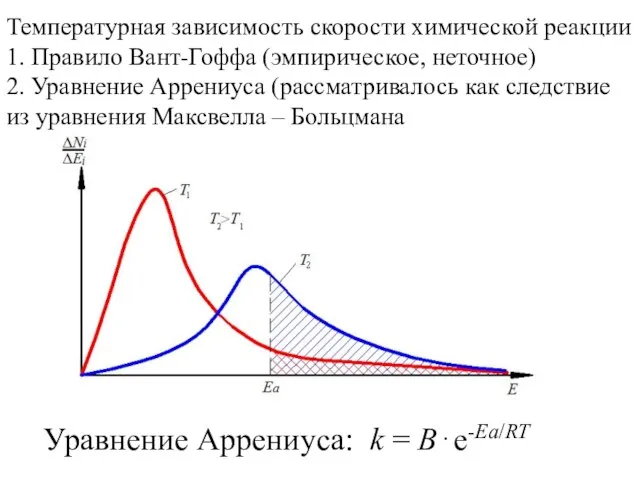
- 2. Некоторая аналогия с распределением Больцмана – итоги сессии за разные семестры Уравнение Аррениуса: k = B⋅e-Ea/RT
- 3. Температурная зависимость скорости химической реакции 1. Правило Вант-Гоффа (эмпирическое, неточное) 2. Уравнение Аррениуса (рассматривалось как следствие
- 4. Теория активных столкновений В теории активных столкновений считается, что акт превращения начальных веществ в конечные продукты
- 5. Теория активированного комплекса (АК) или теория переходного состояния. Основные положения. 1. Превращение проходит через образование АК
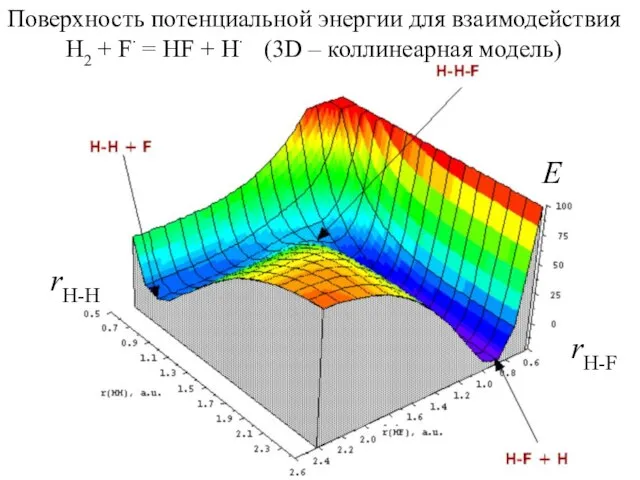
- 7. Поверхность потенциальной энергии для взаимодействия H2 + F∙ = HF + H∙ (3D – коллинеарная модель)
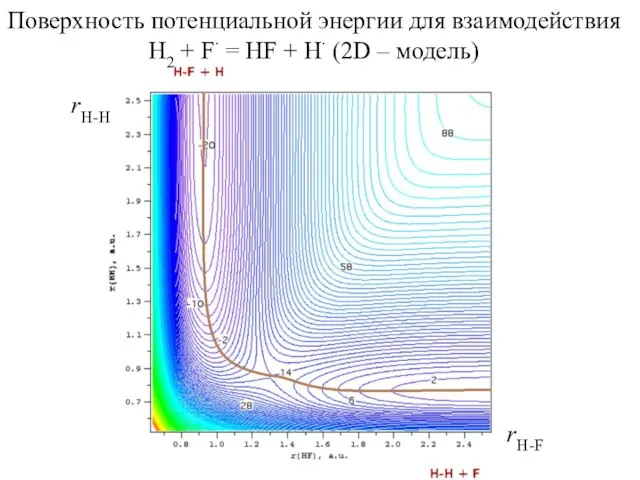
- 8. Поверхность потенциальной энергии для взаимодействия H2 + F∙ = HF + H∙ (2D – модель) rH-H
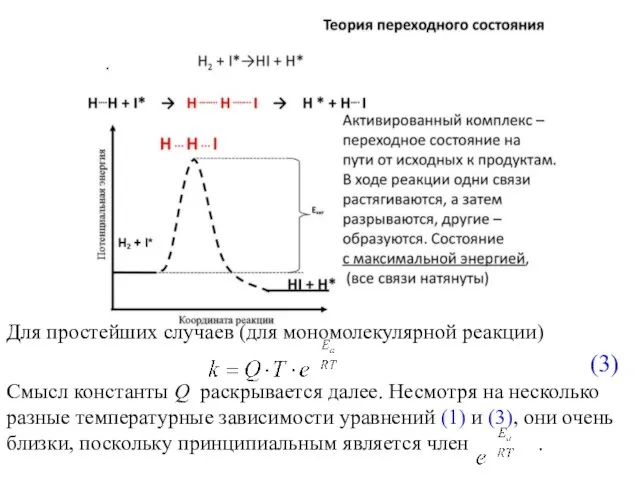
- 9. Для простейших случаев (для мономолекулярной реакции) (3) Смысл константы Q раскрывается далее. Несмотря на несколько разные
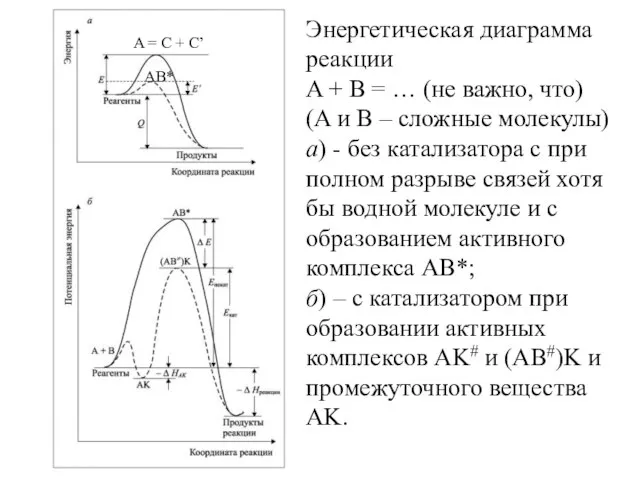
- 10. Энергетическая диаграмма реакции A + B = … (не важно, что) (A и B – сложные
- 11. Реакции, происходящие на границе раздела фаз, называются гетерогенными В гетерогенной реакции всегда есть следующие стадии: доставка
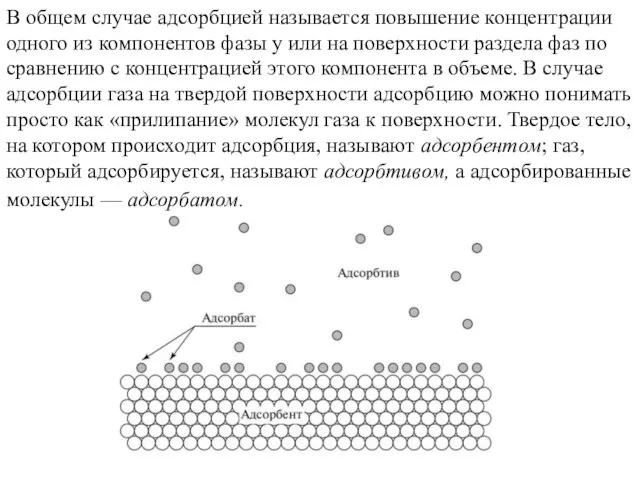
- 12. В общем случае адсорбцией называется повышение концентрации одного из компонентов фазы у или на поверхности раздела
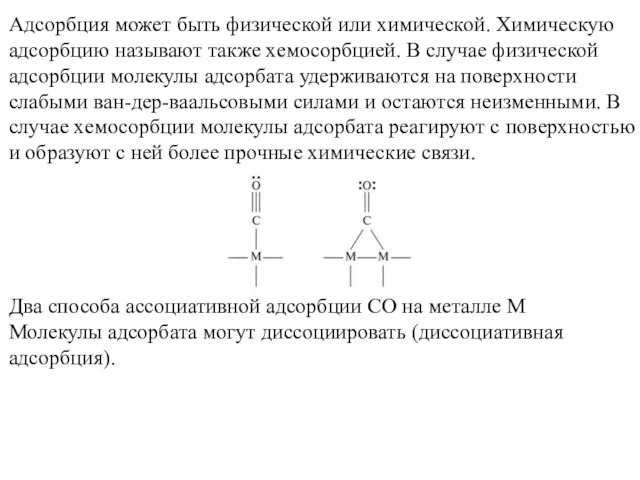
- 13. Адсорбция может быть физической или химической. Химическую адсорбцию называют также хемосорбцией. В случае физической адсорбции молекулы
- 14. P.S.: Давайте различать: Абсорбция (лат. absorptio - поглощение, от absorbeo - поглощаю), поглощение веществ из газовой
- 16. Скачать презентацию





 Ионные уравнения
Ионные уравнения Минералы и горные породы
Минералы и горные породы Производство концентрированной азотной кислоты (лекция 15)
Производство концентрированной азотной кислоты (лекция 15) Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Урок по химии в 10 классе на тему: «Жиры» 2008 год.
Урок по химии в 10 классе на тему: «Жиры» 2008 год. Презентация на тему Теория строения органических соединений А.М. Бутлерова
Презентация на тему Теория строения органических соединений А.М. Бутлерова 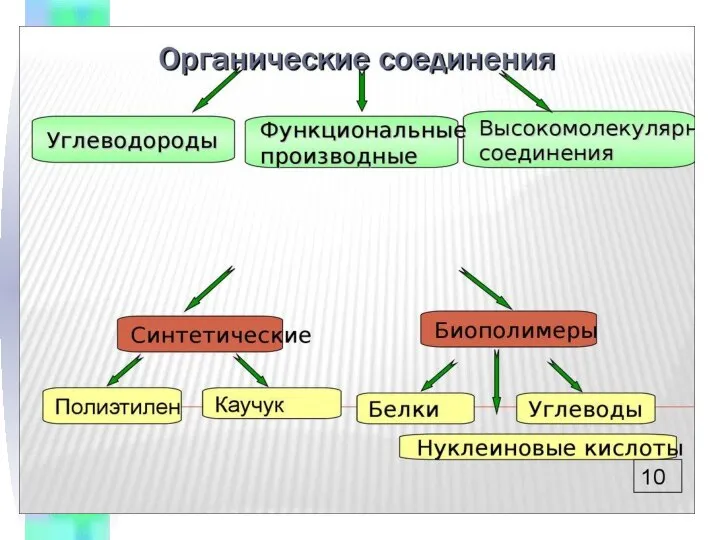 Спирты и их производные
Спирты и их производные Алкины
Алкины Образовательный конкурс Химия - это?! II тур Химия – это практично
Образовательный конкурс Химия - это?! II тур Химия – это практично Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Спирты
Спирты Путешествие в страну Нефтехимия
Путешествие в страну Нефтехимия Химия и сельское хозяйство
Химия и сельское хозяйство Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum
Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum Алкадиены. Каучук
Алкадиены. Каучук Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Анилин
Анилин Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Статистика в аналитической химии
Статистика в аналитической химии Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Синтетическое моторное масло. Маркировка моторных масел
Синтетическое моторное масло. Маркировка моторных масел Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Планарные потенциометрические сенсоры на основе пилларарена -DNS-162
Планарные потенциометрические сенсоры на основе пилларарена -DNS-162