Содержание
- 2. Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при
- 3. Пусть в равновесную систему жидкость А – пар А введено некоторое вещество В. При образовании раствора
- 4. Р = Р0∙ χ , где Р – давление насыщенного пара растворителя над раствором; Р0 –
- 5. 9. Свойства идеальных и реальных растворов. Давление насыщенного пара над идеальными растворами Идеальные растворы. Если раствор
- 6. Если раствор состоит из двух летучих компонентов А и В, то в пар переходит как одна,
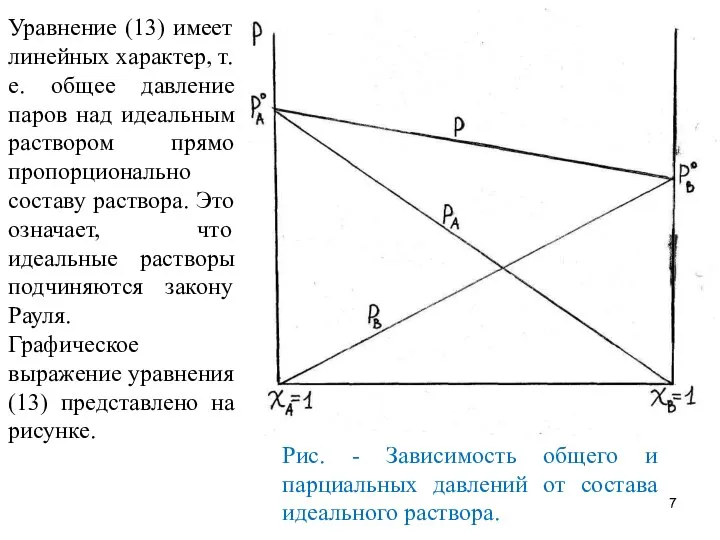
- 7. Уравнение (13) имеет линейных характер, т. е. общее давление паров над идеальным раствором прямо пропорционально составу
- 8. 10. Давление насыщенного пара над реальными растворами. Отклонения от закона Рауля Отклонения кривых Р = f
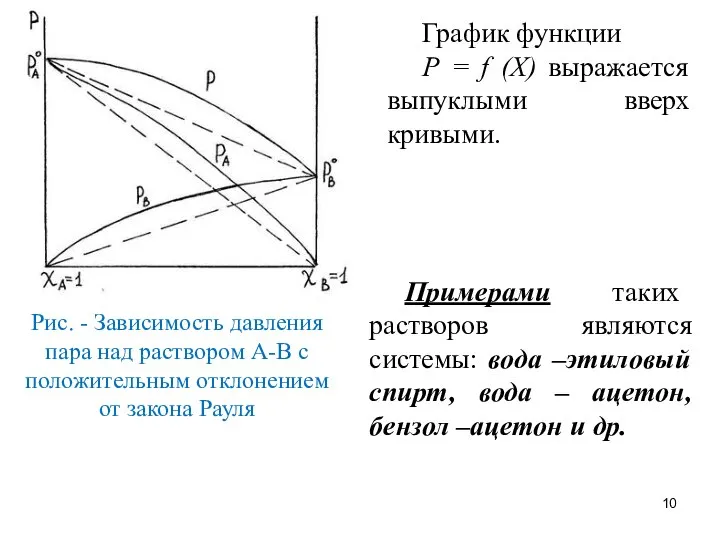
- 9. Положительное отклонение от закона Рауля наблюдается в растворах, если силы взаимодействия между однородными частицами больше, чем
- 10. График функции Р = f (Х) выражается выпуклыми вверх кривыми. Примерами таких растворов являются системы: вода
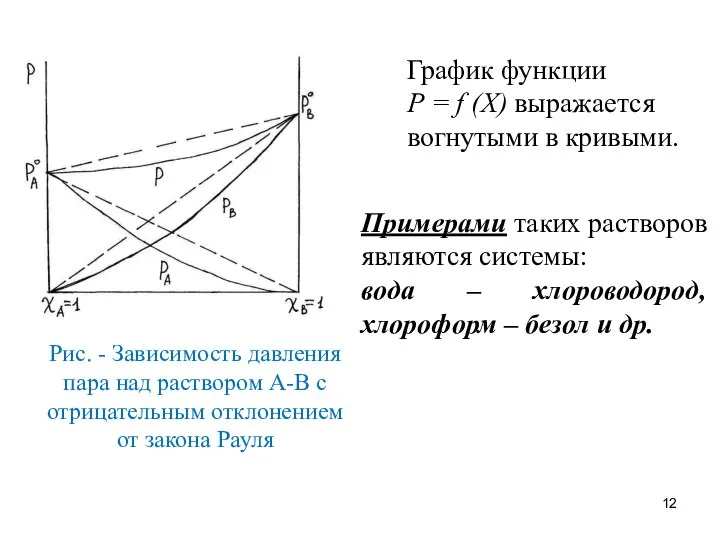
- 11. Отрицательное отклонение от закона Рауля наблюдается в растворах, если силы взаимодействия между однородными частицами меньше, чем
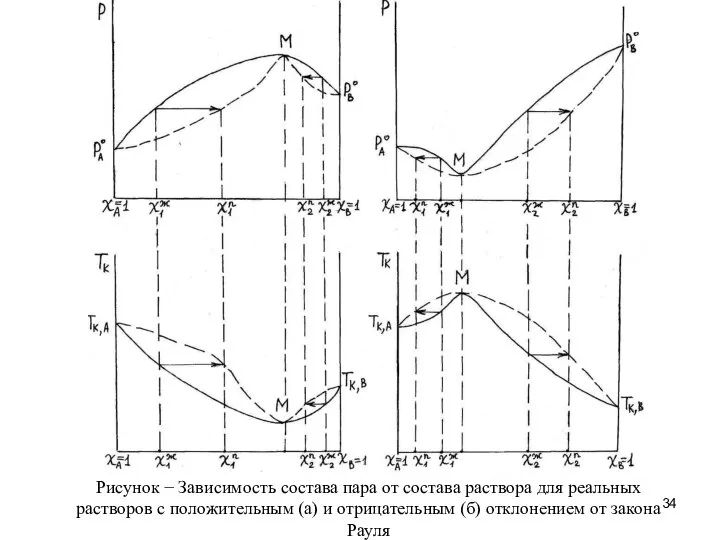
- 12. Рис. - Зависимость давления пара над раствором А-В с отрицательным отклонением от закона Рауля График функции
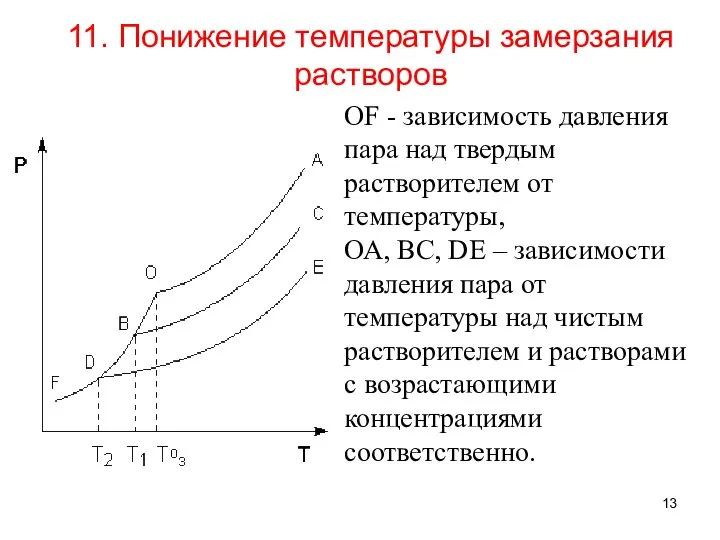
- 13. 11. Понижение температуры замерзания растворов ОF - зависимость давления пара над твердым растворителем от температуры, ОА,
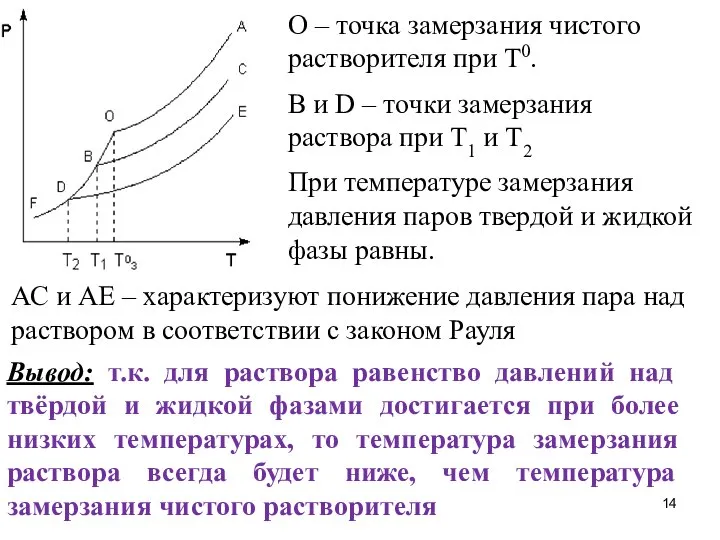
- 14. О – точка замерзания чистого растворителя при Т0. B и D – точки замерзания раствора при
- 15. Понижение температуры замерзания растворов прямо пропорционально моляльной концентрации Сm растворенного вещества: ΔТзам. = К Сm или
- 16. Метод исследования, основанный на измерении понижения температуры замерзания растворов, называется криоскопическим. Для определения молекулярной массы вещества
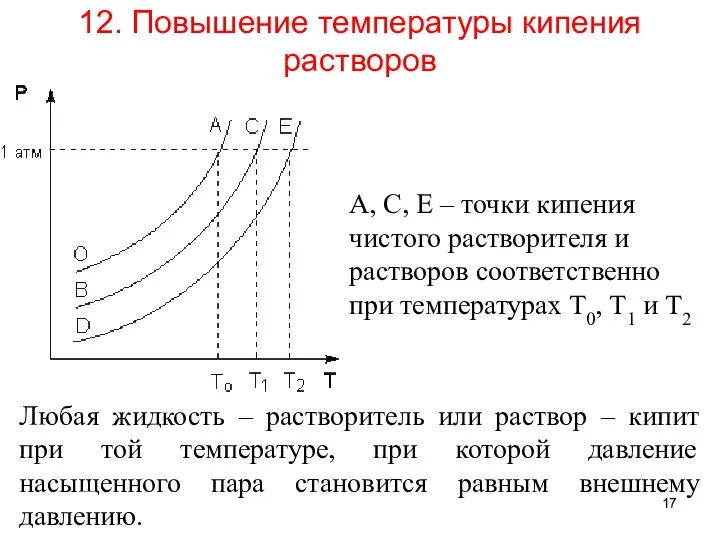
- 17. 12. Повышение температуры кипения растворов Любая жидкость – растворитель или раствор – кипит при той температуре,
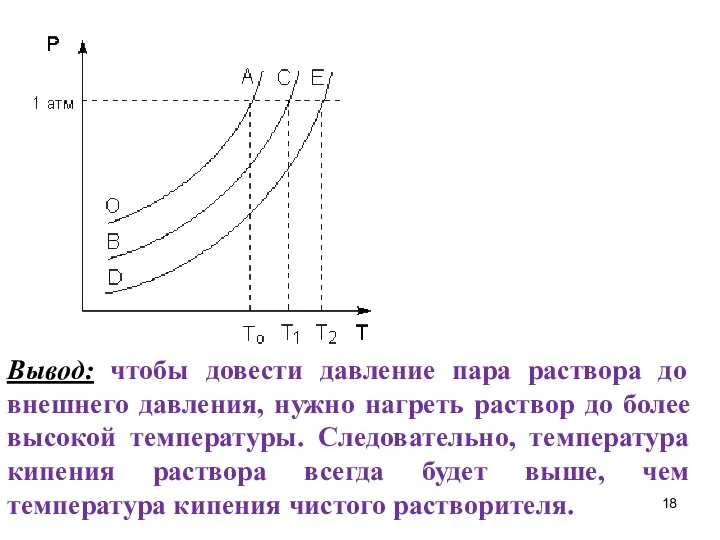
- 18. Вывод: чтобы довести давление пара раствора до внешнего давления, нужно нагреть раствор до более высокой температуры.
- 19. Повышение температуры кипения раствора прямо пропорционально моляльной концентрации растворенного вещества: ΔТкип.= Э Сm или ΔТкип =
- 20. Метод исследования, основанный на измерении повышения температуры кипения растворов, называется эбулиоскопическим. М = Для определения молекулярной
- 21. 13 Состав пара над идеальным раствором. Первый закон Коновалова Зависимость состава пара от состава раствора, состоящего
- 22. Зависимость между составом пара и составом раствора описывается первым законом Коновалова: пар по сравнению с жидкостью,
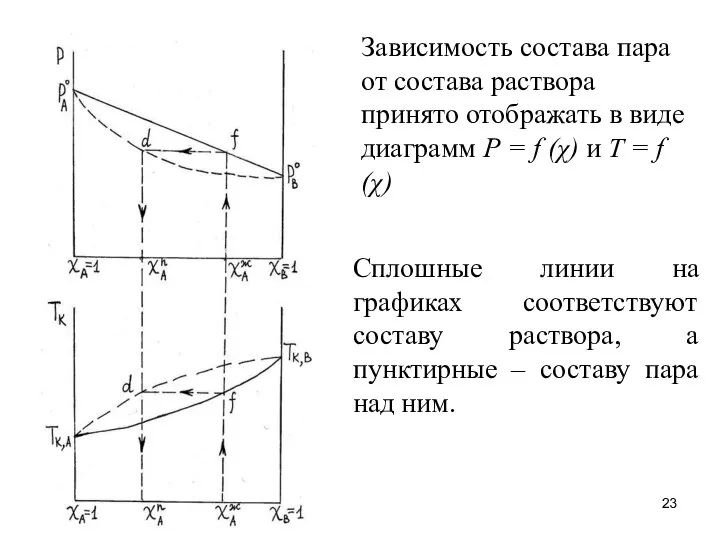
- 23. Зависимость состава пара от состава раствора принято отображать в виде диаграмм Р = f (χ) и
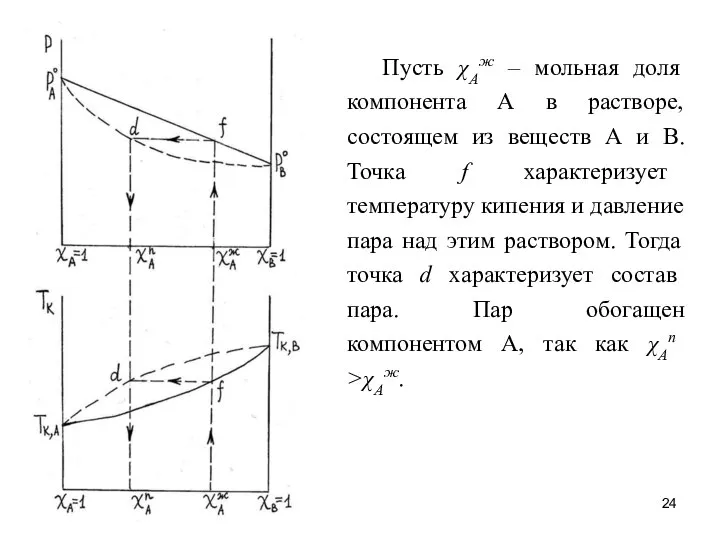
- 24. Пусть χАж – мольная доля компонента А в растворе, состоящем из веществ А и В. Точка
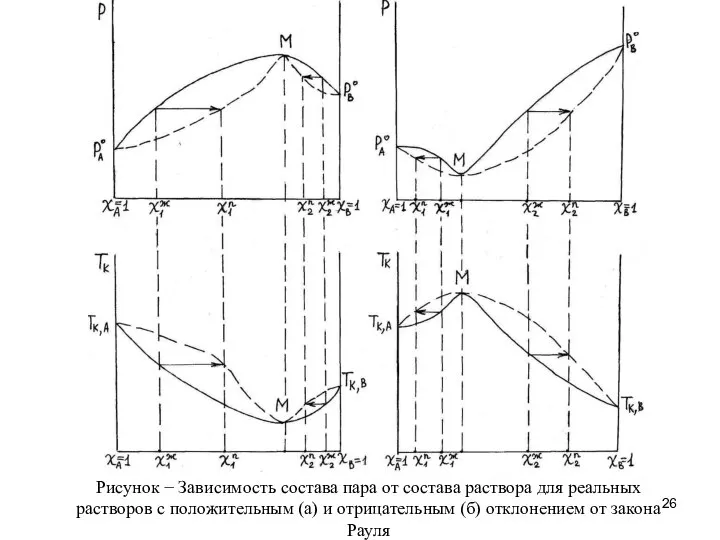
- 25. 13 Состав пара над неидеальным раствором. Второй закон Коновалова Значительные отклонения от закона Рауля в реальных
- 27. Смеси, у которых парообразная и жидкая фазы находятся в равновесии при данных условиях и имеют одинаковый
- 28. 14. Перегонка растворов Перегонка – это процесс, основанный на различии в составе пара и жидкости (т.
- 29. Рассмотрим диаграмму Т = f (χ) для раствора А-В, свойства которого близки к идеальному. Жидкость с
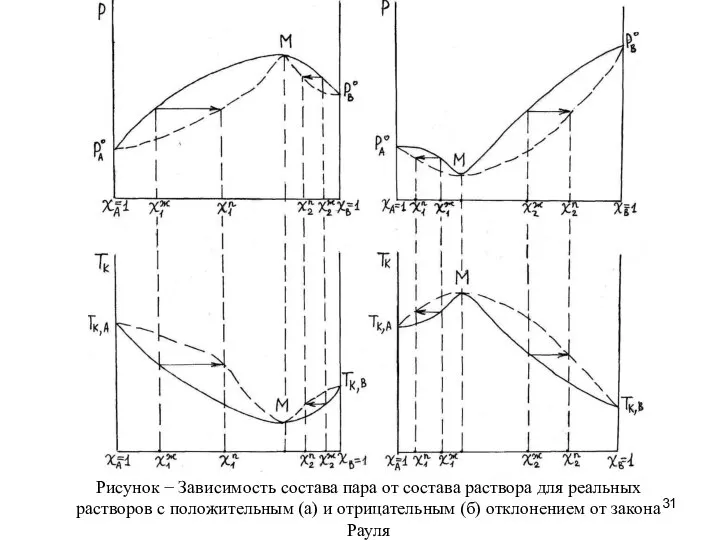
- 30. Перегонка реальных растворов. Если раствор является неидеальным и при этом образует азеотропную смесь, то полное разделение
- 32. При перегонке растворов с положительным отклонением от закона Рауля состав дистиллята стремится к составу азеотропной смеси,
- 33. При перегонке растворов с отрицательным отклонением от закона Рауля состав кубового остатка стремится к составу азеотропной
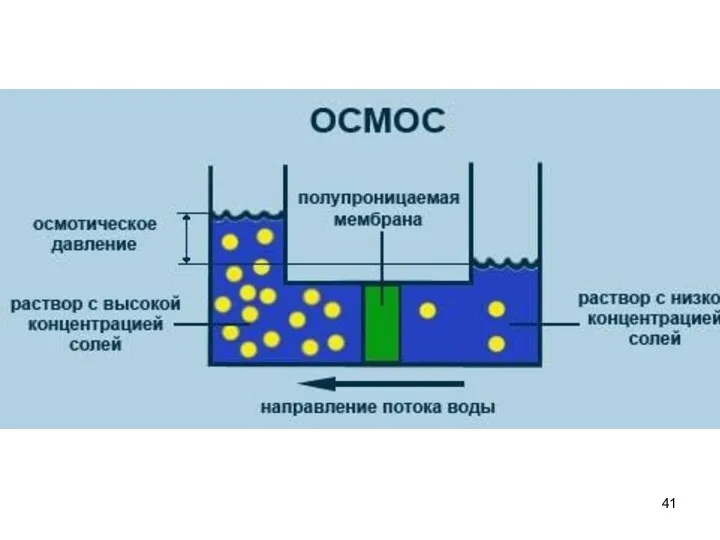
- 35. 15. Осмотическое давление Все растворы обладают способностью к диффузии. Диффузия - это равномерное распределение вещества по
- 36. Можно создать условие, при котором диффузия протекает только в одном направлении. Для этого раствор и растворитель
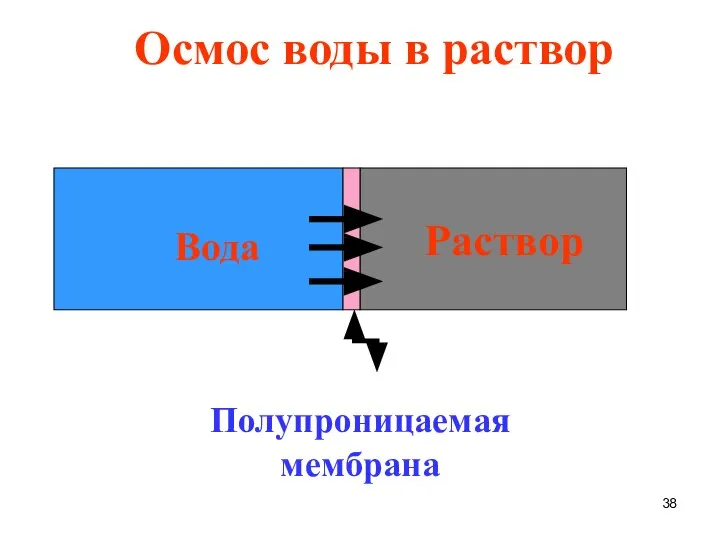
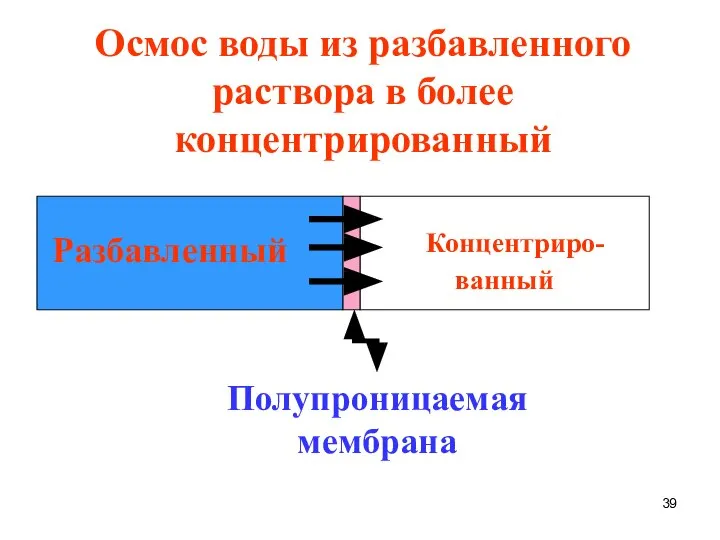
- 37. Осмос - односторонняя диффузия растворителя через полупроницаемую мембрану из растворителя в раствор или из разбавленного раствора
- 38. Раствор Вода Полупроницаемая мембрана Осмос воды в раствор
- 39. Концентриро- ванный Разбавленный Полупроницаемая мембрана Осмос воды из разбавленного раствора в более концентрированный
- 40. Осмотическое давление π — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при
- 42. Осмотическое давление описывается уравнением Вант- Гоффа. Для неэлектролитов: π = С ×R×T Для электролитов: π =
- 44. Скачать презентацию

























 Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия 1_
1_ Алканы. Циклоалканы
Алканы. Циклоалканы Галогены и их соединения
Галогены и их соединения Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Коллоидные системы
Коллоидные системы Биохимия статическая, динамическая, функциональная
Биохимия статическая, динамическая, функциональная Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти  Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Презентация на тему Гормоны
Презентация на тему Гормоны  Ovr-1
Ovr-1 Химические и физические свойства воды
Химические и физические свойства воды Алканы 10-класс
Алканы 10-класс Презентация на тему Химические свойства металлов
Презентация на тему Химические свойства металлов  Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты
Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты Алкины. Пропин
Алкины. Пропин Применение алкенов
Применение алкенов Презентация на тему Кислород О2
Презентация на тему Кислород О2  Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Криптон. Самостоятельная работа
Криптон. Самостоятельная работа Презентация на тему Классификация химических реакций (11 класс)
Презентация на тему Классификация химических реакций (11 класс)