Содержание
- 2. Все что нас окружает состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой.
- 3. Отгадай загадку и узнай о чем пойдет речь на сегодняшнем уроке Она идет, она прошла! Никто
- 4. Что такое химическая реакция? Химические реакции или химические явления – это процессы, в результате которых из
- 5. По каким признакам можно определить химические реакции? Выделение газа; Образование осадка; Выделение (поглощение) тепла и света;
- 6. Каковы условия возникновения реакций: 1) Образование хлорида аммония 2) Горение магния 3) Взаимодействие алюминия с иодом
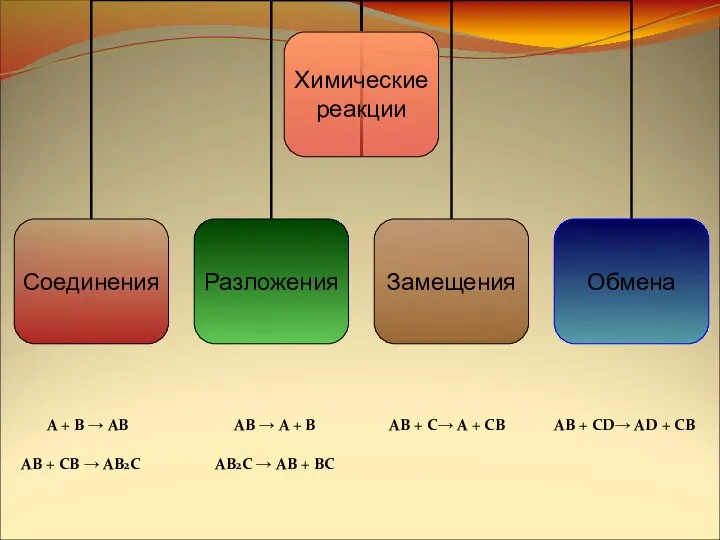
- 7. Химические реакции. Как классифицировать ?
- 8. Тема урока: «Типы химических реакций» Запишите тему в рабочую тетрадь
- 9. 2H2 + O2 → 2H2O CaO + H2O → Ca(OH)2 Cu(OH)2 → CuO + H2O; 2HgO
- 10. 2H2 + O2 → 2H2O 4P + 5O2 → 2P2O5 Na2O + SO3 → Na2SO4 CaO
- 11. Cu(OH)2 → CuO + H2O 2HgO → 2Hg + O2 CaCO3 → CaO + CO2 2NO
- 12. CuCl2 + Fe → Cu + FeCl2 Cr2O3 + 2Al → 2Cr + Al2O3 Zn +
- 13. CuO + 2HCl → CuCl2 + H2О BaCl2 + K2SO4 → BaSO4 + 2KCl Что объединяет
- 14. A + B → AB AB + CB → AB2C AB → A + B AB2C
- 15. Выполнение эксперимента Внимательно прочитайте инструктивную карточку по проведению опыта. Соблюдая технику безопасности проведите химическую реакцию. Определите
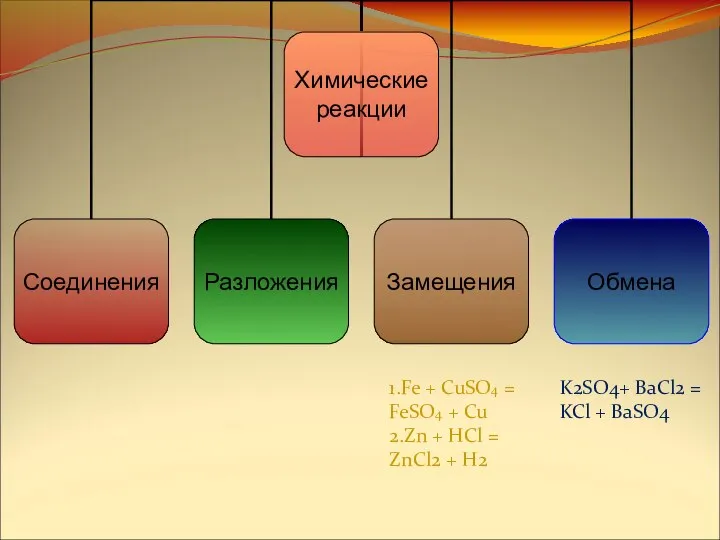
- 16. K2SO4+ BaCl2 = KCl + BaSO4 1.Fe + CuSO4 = FeSO4 + Cu 2.Zn + HCl
- 17. Определите по предложенным схемам основные типы химических реакций. FeCl2 + Zn = ZnCl2 + Fe 2KClO3
- 18. Соотнесите типы химических реакций и схемы реакций: 1.соединения а.Fe + O2 = FeO 2.разложения б.PbCl2 +Zn(NO3)2
- 19. Проверим: Тест №1 1-замещение 2-разложение 3-обмена 4-соединения Тест№2 Разложение -г,е Замещение - в,з Обмен – б,ж
- 21. Скачать презентацию
















 Деятельностный подход в изучении химии
Деятельностный подход в изучении химии Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Презентация на тему Многообразие карбоновых кислот
Презентация на тему Многообразие карбоновых кислот  Степень окисления в соединениях
Степень окисления в соединениях Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Производство полимеров в РК
Производство полимеров в РК Природный газ
Природный газ Основания
Основания Продукты и процессы переработки нефти
Продукты и процессы переработки нефти Классификация органических веществ
Классификация органических веществ Презентация на тему Соли угольной кислоты
Презентация на тему Соли угольной кислоты  Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Презентация на тему Глицерин
Презентация на тему Глицерин  AMFOTERNOST__1
AMFOTERNOST__1 Оксиды в свете ТЭД
Оксиды в свете ТЭД Кислоты. Классификация. Номенклатура
Кислоты. Классификация. Номенклатура Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Кристаллическая структура вещества. Характеристика вещества по формуле
Кристаллическая структура вещества. Характеристика вещества по формуле Полимерные материалы
Полимерные материалы gidroliz_soley (1)
gidroliz_soley (1) Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Железо. 9 класс
Железо. 9 класс Коррозия металлов
Коррозия металлов Химические свойства воды
Химические свойства воды Электролитическая диссоциация
Электролитическая диссоциация