Слайд 2Ковалентная связь
Ковалентной связью называется химическая связь, образующаяся за счёт обобществления атомами своих
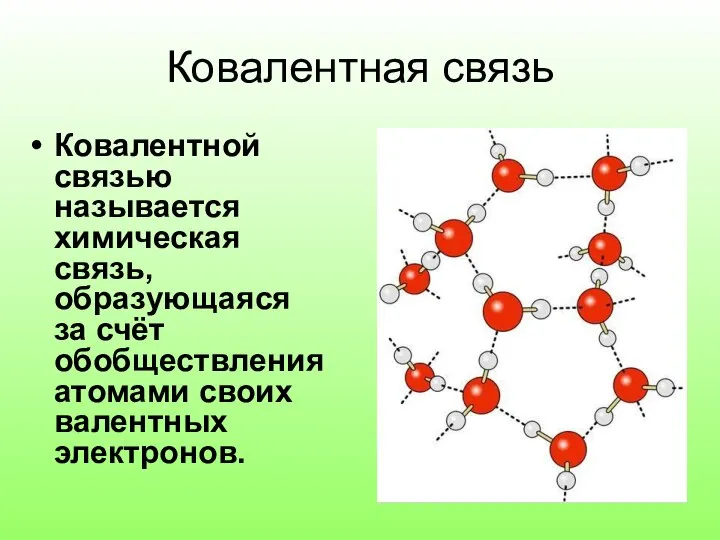
валентных электронов.
Слайд 3Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых
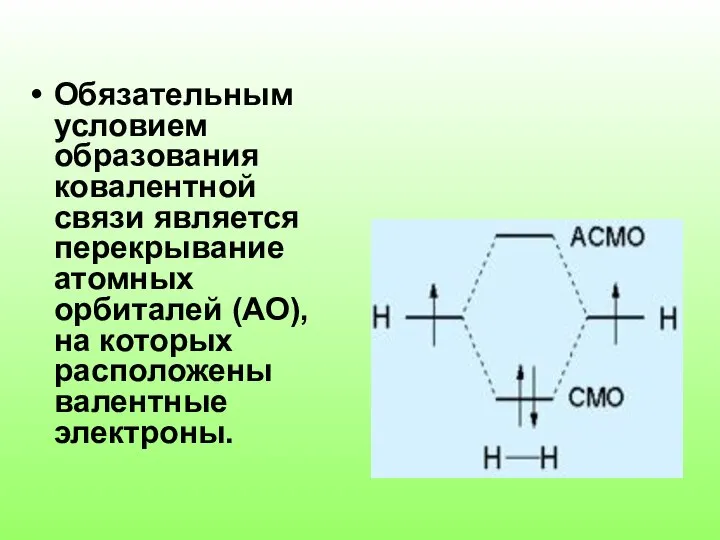
расположены валентные электроны.
Слайд 4Химическая связь, возникающая в результате образования общих электронных пар, называется атомной или

ковалентной
Слайд 5КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ ПОЛЯРНАЯ
Δ Э.О. = 0
2 > Δ Э.О. >
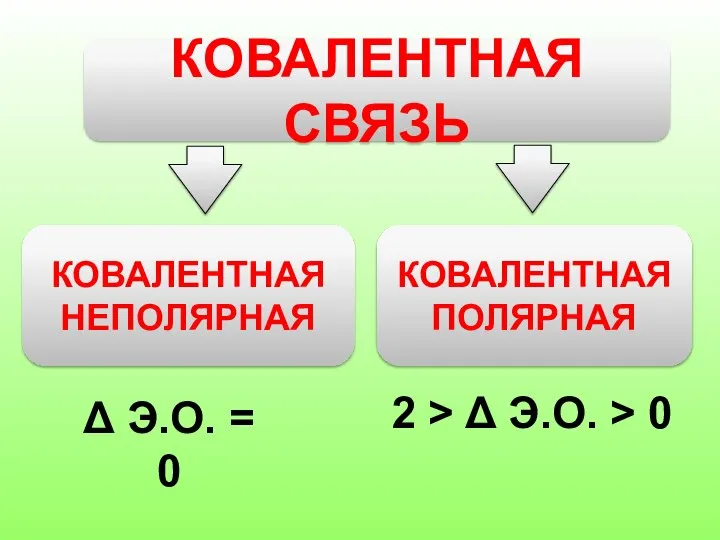
0
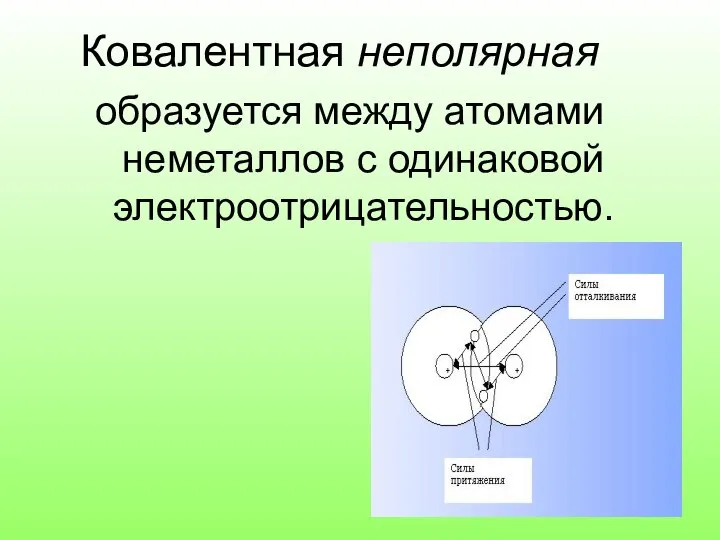
Слайд 6Ковалентная неполярная
образуется между атомами неметаллов с одинаковой электроотрицательностью.
Слайд 7H· + ·Н = Н : Н
Δ Э.О. = 2,1 –
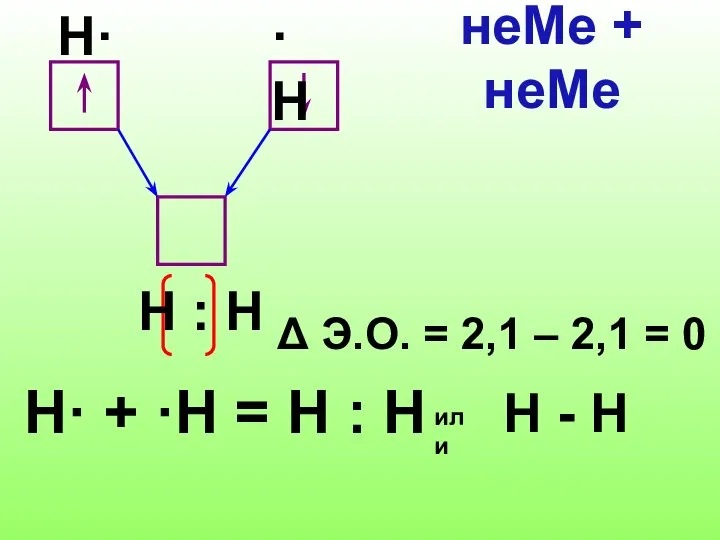
2,1 = 0
неМе + неМе
H·
·H
Н : Н
или
Н - Н
Слайд 8Ковалентная полярная связь
Ковалентная связь между атомами элементов, электроотрицательности которых различаются называют полярной

Слайд 11Молекулярная кристаллическая решётка
Характерны для веществ с ковалентной связью
Между молекулами слабые силы межмолекулярного
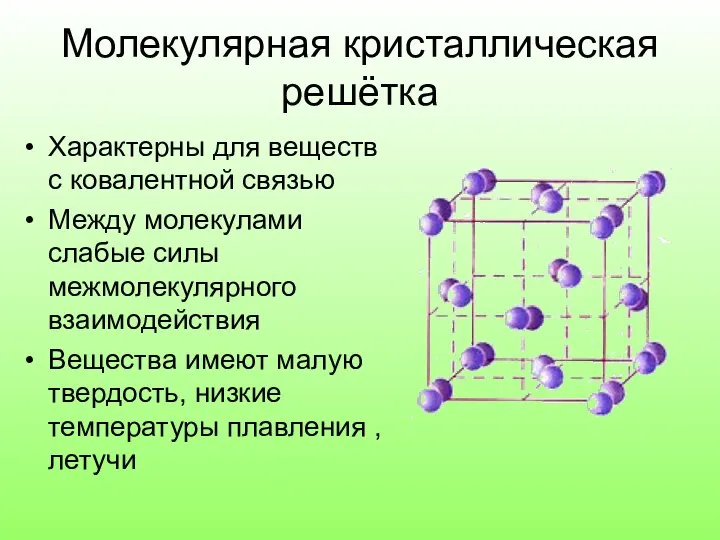
взаимодействия
Вещества имеют малую твердость, низкие температуры плавления , летучи
Слайд 12Ковалентная донорно-акцепторная
связь
ДОНОР
АКЦЕПТОР
имеет неподеленную - имеет свободную
электронную пару орбиталь
ПРИМЕР: (NH₄)⁺
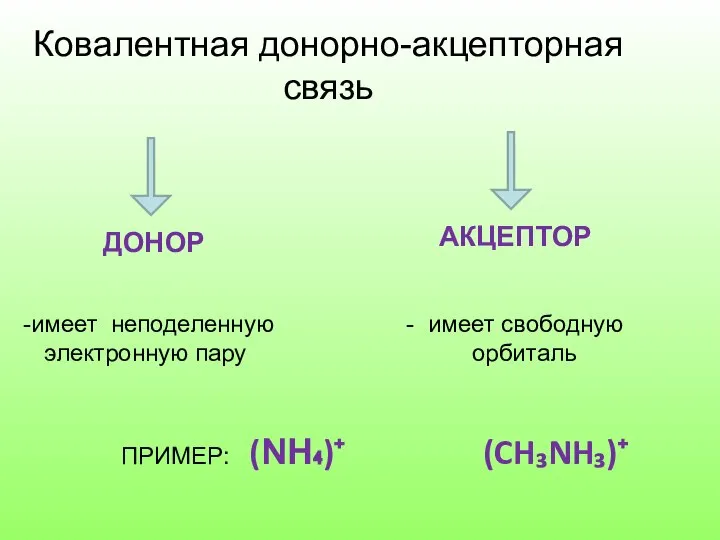
(CH₃NH₃)⁺










 Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Полиуретановые полимеры
Полиуретановые полимеры Алкадиены. Физические свойства
Алкадиены. Физические свойства Презентация на тему Применение этанола и влияние его на человека
Презентация на тему Применение этанола и влияние его на человека  Реакции соединения и разложения
Реакции соединения и разложения 11. Дисперсные системы
11. Дисперсные системы obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Формула аспирина. Решение задач
Формула аспирина. Решение задач Основания
Основания Тепловые, массобменные и химические процессы
Тепловые, массобменные и химические процессы Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Металлы. Общие свойства
Металлы. Общие свойства Классы неорганических соединений
Классы неорганических соединений Презентация на тему Нефть и способы ее переработки
Презентация на тему Нефть и способы ее переработки 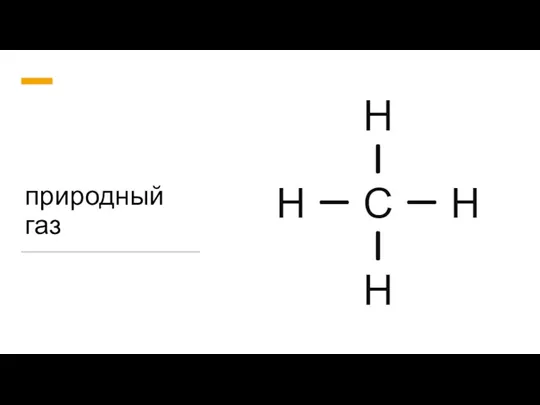 Природный газ
Природный газ Введение в химию. История химии
Введение в химию. История химии Галогены. Возможные степени окисления
Галогены. Возможные степени окисления Химия на войне
Химия на войне Минерал гранат
Минерал гранат Дисперсные системы
Дисперсные системы Атомы, вещества, молекулы
Атомы, вещества, молекулы Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс) 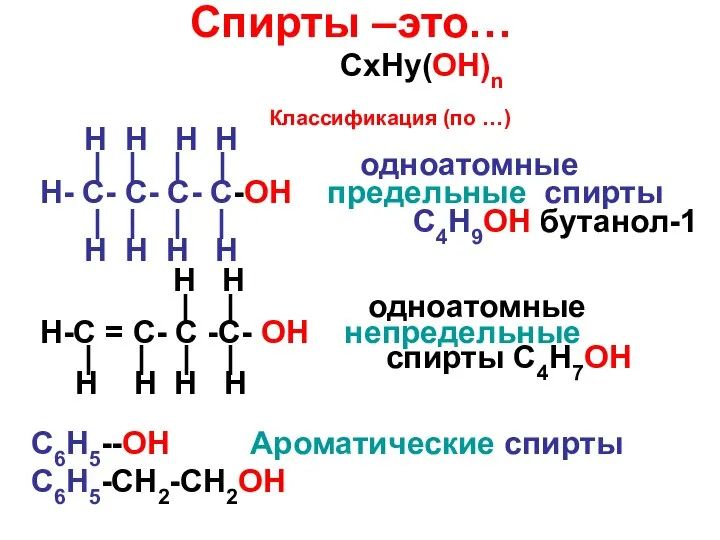 Спирты –это…
Спирты –это… Применение обратимых и необратимых реакций в быту
Применение обратимых и необратимых реакций в быту Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра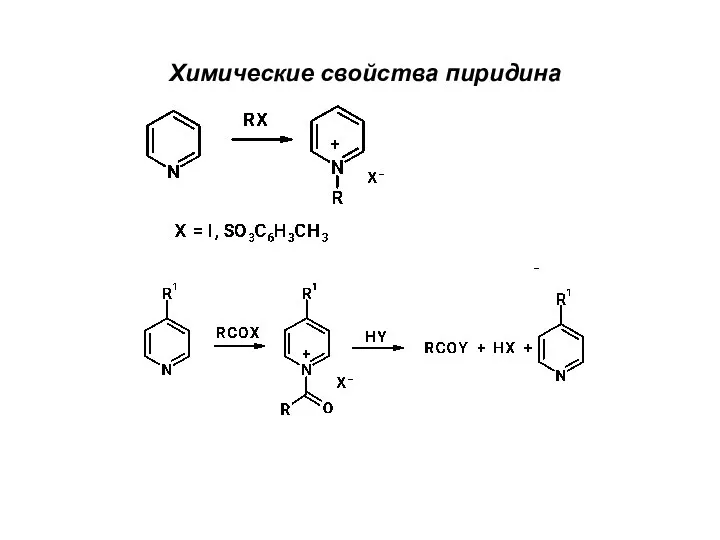 Химические свойства пиридина
Химические свойства пиридина Знакомый и незнакомый углерод (9 класс)
Знакомый и незнакомый углерод (9 класс)