Слайд 2Понятие
Спирты (алканолы) – органические вещества, молекулы которых содержат одну или несколько

гидроксильных групп (групп –ОН), соединенных с углеводородным радикалом.
Общая формула одноатомных предельных спиртов СnН2n+1ОН
Слайд 3Классификация спиртов
По углеводородному
радикалу:

Слайд 4НОМЕНКЛАТУРА И ИЗОМЕРИЯ
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют

(родовой) суффикс – ОЛ.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи:
H H H H H H H
| |3 |2 |1 | 1 | 2 |3
H- C – O H H- C – C – C -OH H - C – C – C -H
| | | | | | |
H H H H H OH H
метанол пропанол-1 пропанол -2
ВИДЫ ИЗОМЕРИИ:
1. Изомерия положения функциональной группы (пропанол–1 и пропанол–2)
2.Изомерия углеродного скелета
CH3-CH2-CH2-CH2-OH CH3-CH-CH2-OH
бутанол-1 |
CH3 2-метилпропанол-1
3.Изомерия межклассовая – спирты изомерны простым эфирам:
СН3-СН2-ОН СН3-О-СН3
этанол диметиловый эфир
Слайд 5Способы получения
Лабораторные:
Гидролиз галогеналканов:
R-CL+NaOH R-OH+NaCL
Гидратация алкенов: CH2=CH2+H2O C2H5OH
Гидрирование карбонильных соединений

Промышленные:
Синтез метанола из синтез-газа
CO+2H2 CH3-OH(при повышенном давлении, высокой температуре и катализатора оксида цинка)
Гидратация алкенов
Брожение глюкозы: C6H12O6 2C2H5OH+2CO2
Слайд 6ФИЗИЧЕСКИЕ СВОЙСТВА
Низшие спирты (С1-C11)-летучие жидкости с резким запахом
Высшие спирты (C12- и выше)-
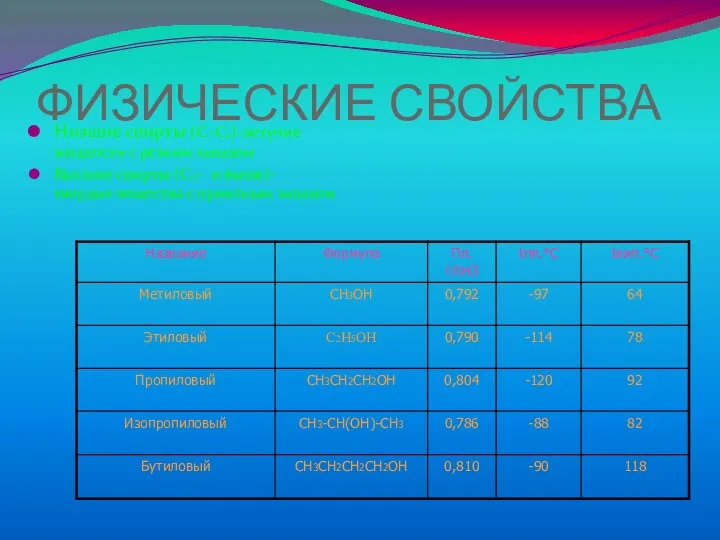
твердые вещества с приятным запахом
Слайд 7Химические свойства
I. Реакции с разрывом связи RO–H
Спирты реагируют с щелочными и щелочноземельными

металлами, образуя солеобразные соединения – алкоголяты.
2СH3CH2CH2OH + 2Na → 2СH3CH2CH2ONa + H2↑
2СH3CH2OH + Сa → (СH3CH2O)2Ca + H2↑
Взаимодействие с органическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
CH3COОH + HOC2H5 → CH3COОC2H5 (уксусноэтиловый эфир (этилацетат)) + H2O
Слайд 9 II. Реакции с разрывом связи R–OH.
С галогеноводородами:
R–OH + HBr

↔ R–Br + H2O
III. Реакции окисления
Спирты горят:
2С3H7ОH + 9O2 → 6СO2 + 8H2O
При действии окислителей:
первичные спирты превращаются в альдегиды
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами(конц. Н2SO4).
1. Внутримолекулярная дегидратация приводит к образованию алкенов
CH3–CH2–OH → CH2=CH2 + H2O
2. Межмолекулярная дегидратация даёт простые эфиры
R-OH + H-O–R → R–O–R(простой эфир) + H2O









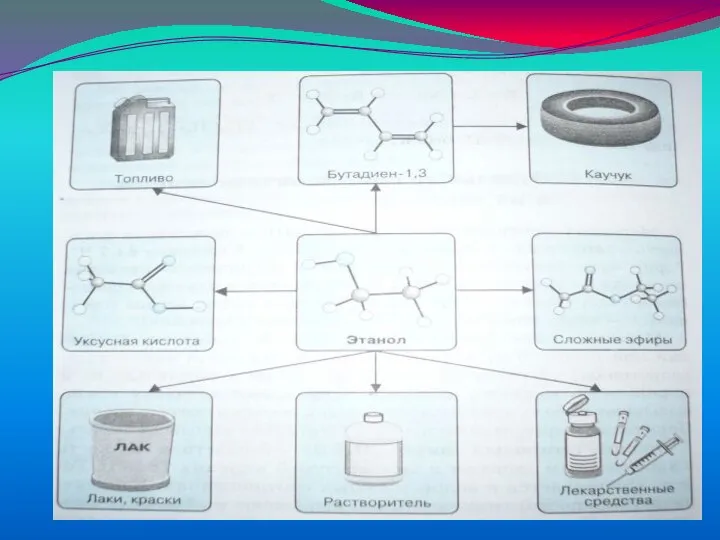
 Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Строение и химические свойства глюкозы
Строение и химические свойства глюкозы Амилаза. Строение амилазы
Амилаза. Строение амилазы Посвящение в химики
Посвящение в химики Металлы p-семейства
Металлы p-семейства Подготовка к ГИА 2021
Подготовка к ГИА 2021 Серная кислота
Серная кислота Спирты и фенолы
Спирты и фенолы Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Технология производства органических лекарственных веществ. Препараты алифатического ряда: хлороформ, йодоформ, хлоральгидрат
Технология производства органических лекарственных веществ. Препараты алифатического ряда: хлороформ, йодоформ, хлоральгидрат Кальций
Кальций Углеводороды
Углеводороды Классификация и номенклатура ОС
Классификация и номенклатура ОС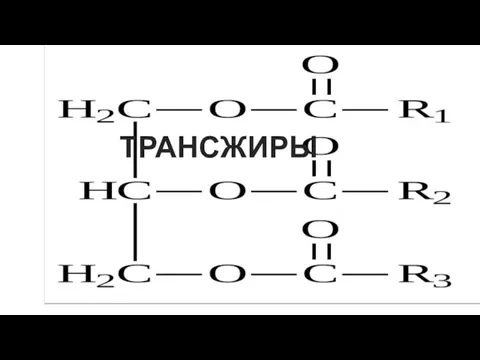 Трансжиры и их анализ
Трансжиры и их анализ Презентация на тему Дисперсные системы
Презентация на тему Дисперсные системы  Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Элементы таблицы Менделеева
Элементы таблицы Менделеева Теплота растворения
Теплота растворения Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Кремний и его соединения
Кремний и его соединения Диффузия в газах, жидкостях и твердых телах
Диффузия в газах, жидкостях и твердых телах Химический футбол на тему: Химия вокруг нас
Химический футбол на тему: Химия вокруг нас Тесты по химии (вопросы)
Тесты по химии (вопросы) Мезомерный эффект
Мезомерный эффект Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики 9. Потомки светоносного элемента
9. Потомки светоносного элемента Минеральные кислоты. Взаимодействие с простыми веществами
Минеральные кислоты. Взаимодействие с простыми веществами