Содержание
- 2. Как же химики судят о том, является ли данное вещество кислотой? Растворы всех кислот на вкус
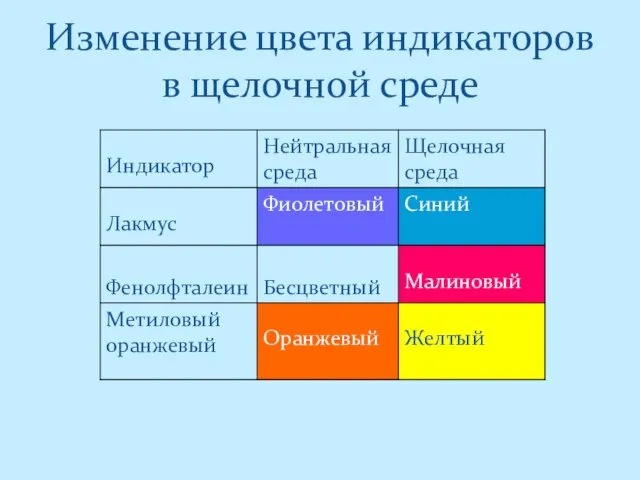
- 3. 1)Что такое индикаторы? 2)Какие индикаторы вы знаете? 3) Как индикаторы меняют цвет в щелочной среде?
- 4. Изменение цвета индикаторов в щелочной среде
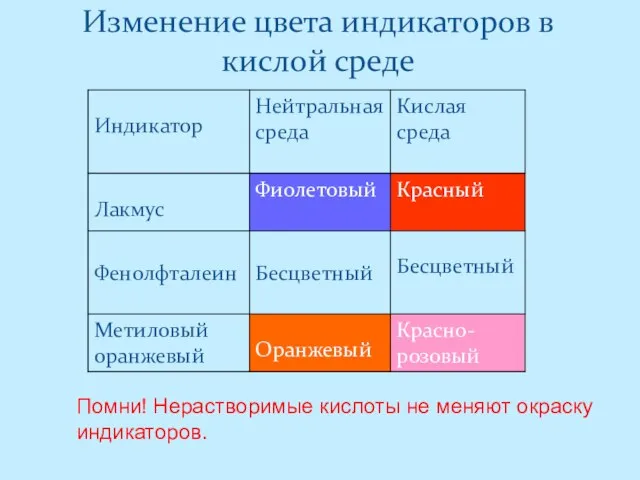
- 5. Изменение цвета индикаторов в кислой среде Помни! Нерастворимые кислоты не меняют окраску индикаторов.
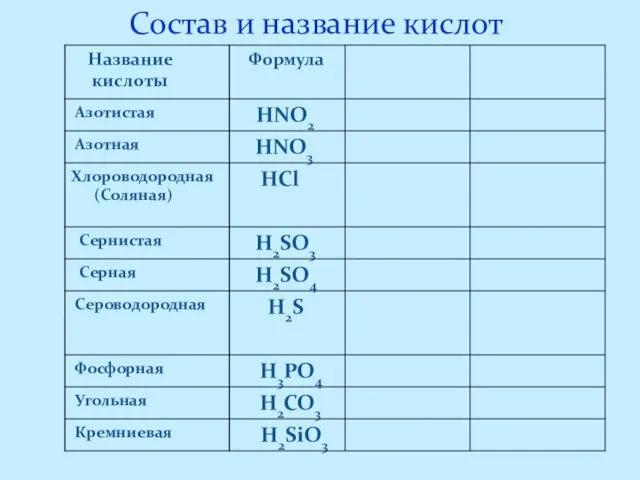
- 6. Состав и название кислот
- 7. Кислоты – это сложные вещества, молекулы, которых состоят из атомов водорода и кислотных остатков
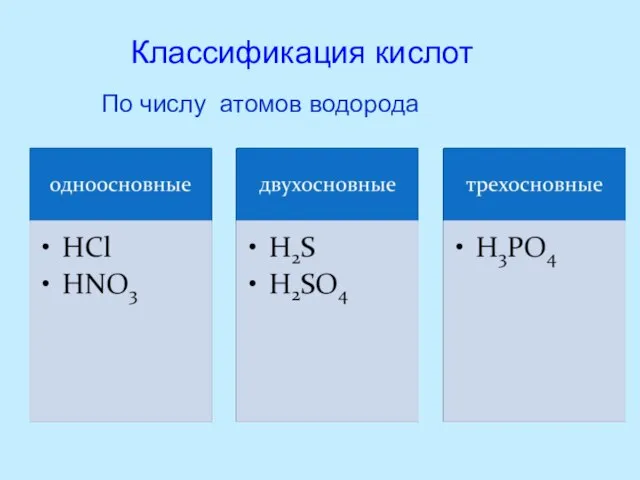
- 8. По числу атомов водорода Классификация кислот
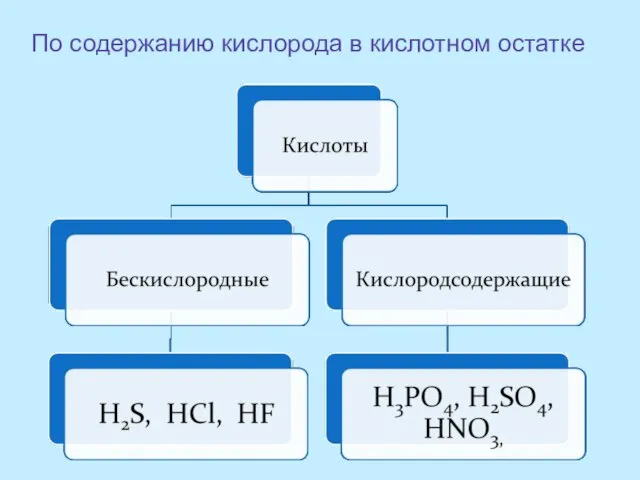
- 9. По содержанию кислорода в кислотном остатке
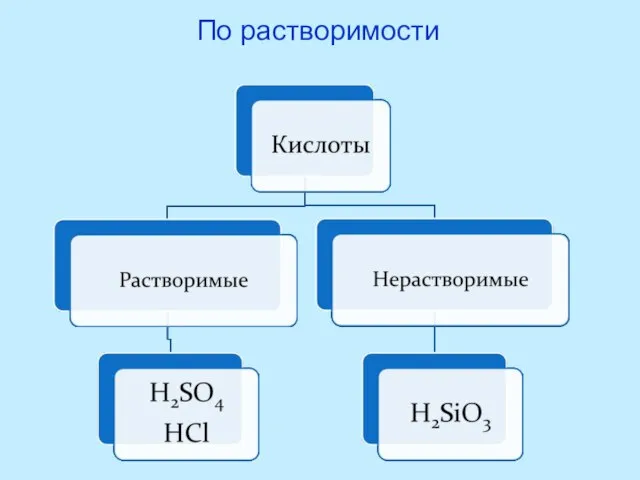
- 10. По растворимости
- 13. Серная кислота бесцветная , вязкая жидкость, без запаха, вдвое тяжелее воды, поглощает влагу из воздуха и
- 14. Обугливание лучинки серной кислотой
- 15. Обугливание сахара серной кислотой
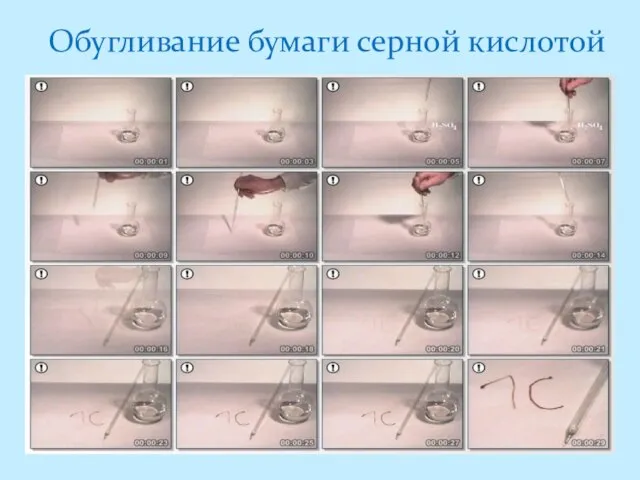
- 16. Обугливание бумаги серной кислотой
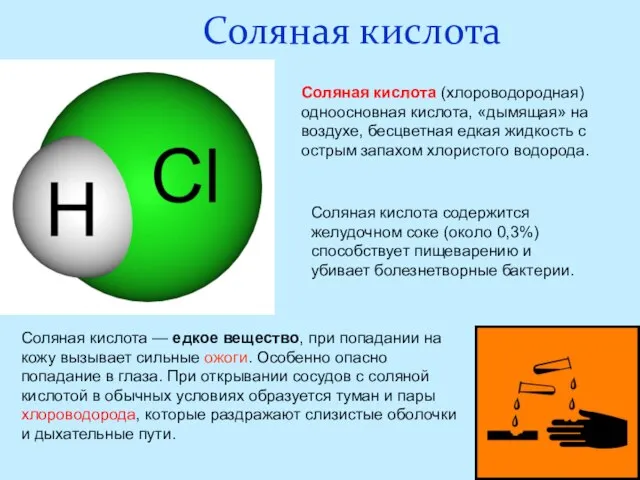
- 17. Соляная кислота Соляная кислота содержится желудочном соке (около 0,3%) способствует пищеварению и убивает болезнетворные бактерии. Соляная
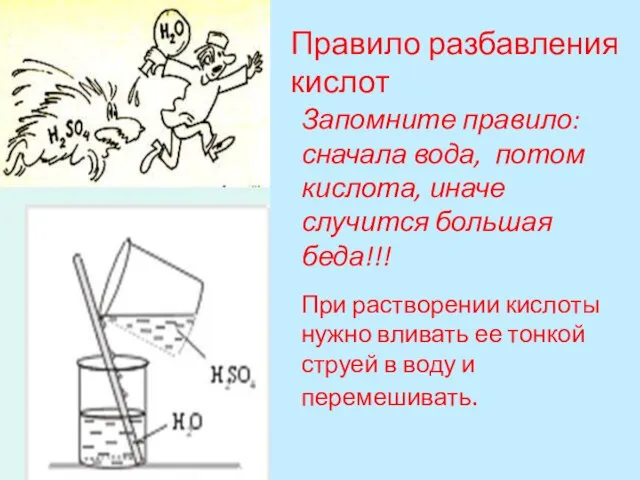
- 18. Правило разбавления кислот При растворении кислоты нужно вливать ее тонкой струей в воду и перемешивать. Запомните
- 20. ЕСЛИ КИСЛОТА ПОПАЛА НА КОЖУ. Пораженный участок кожи промывают сильно скользящей струей холодной воды в течение
- 21. H2CO3 → CO2↑ + H2O H2SO3 → SO2↑ + H2O В свободном виде не существуют. Они
- 22. Как узнать какие оксиды соответствуют данным кислотам? Помните, что суммарная степень окисления атомов всех элементов в
- 23. Проверь себя Выберите группу веществ, в состав которой входят только кислоты HCl, SO3, NaOH,CuCl2 HNO3, H2S,
- 24. Проверь себя Выберите группу веществ, в состав которой входят только двухосновные кислоты HNO3, H2S, HCl, H3PO4
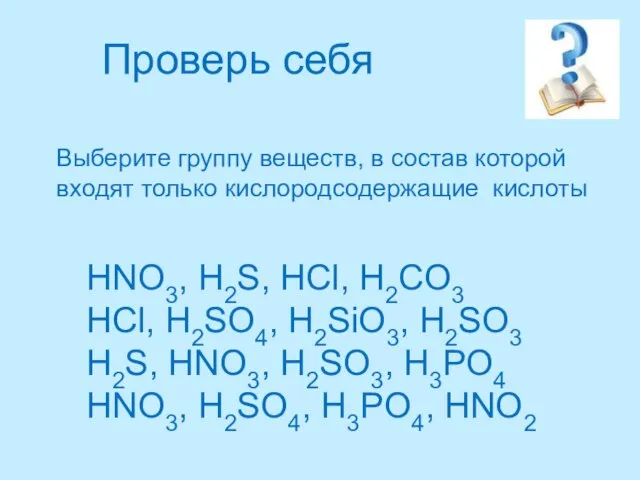
- 25. HNO3, H2S, HCl, H2CO3 HCl, H2SO4, H2SiO3, H2SO3 H2S, HNO3, H2SO3, H3PO4 HNO3, H2SO4, H3PO4, HNO2
- 26. Проверь себя В кислой среде синий лакмус становится: фиолетовым красным малиновым не изменяет окраску
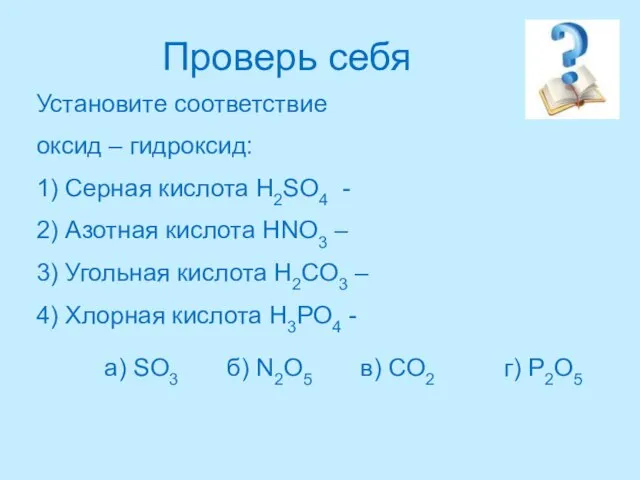
- 27. Проверь себя Установите соответствие оксид – гидроксид: 1) Серная кислота H2SO4 - 2) Азотная кислота HNO3
- 28. Вспомните правило разбавления кислот
- 30. Скачать презентацию















 Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии Презентация на тему Обобщение сведений об основных классах неорганических веществ
Презентация на тему Обобщение сведений об основных классах неорганических веществ  задачи
задачи Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Домашняя работа по теме Фенол
Домашняя работа по теме Фенол Классификация органических соединений
Классификация органических соединений Вывод формул химических веществ
Вывод формул химических веществ Зонная структура металлов, диэлектриков и полупроводников
Зонная структура металлов, диэлектриков и полупроводников Слюда. История открытия
Слюда. История открытия Электроотрицательность химических элементов
Электроотрицательность химических элементов Vielu īpašības
Vielu īpašības Соединения азота
Соединения азота Щелочноземельные металлы
Щелочноземельные металлы Коррозия металлов
Коррозия металлов Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической
Физическая химия. Лекция 1. Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Галогеналканы и реакции отщепления
Галогеналканы и реакции отщепления Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Основания
Основания Реакции соединения
Реакции соединения Электролитическая диссоциация. Сванте Август Аррениус (1859 – 1927)
Электролитическая диссоциация. Сванте Август Аррениус (1859 – 1927) Презентация на тему Йод
Презентация на тему Йод  Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Дисахариды и полисахариды
Дисахариды и полисахариды Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Резиновая краска
Резиновая краска