Содержание
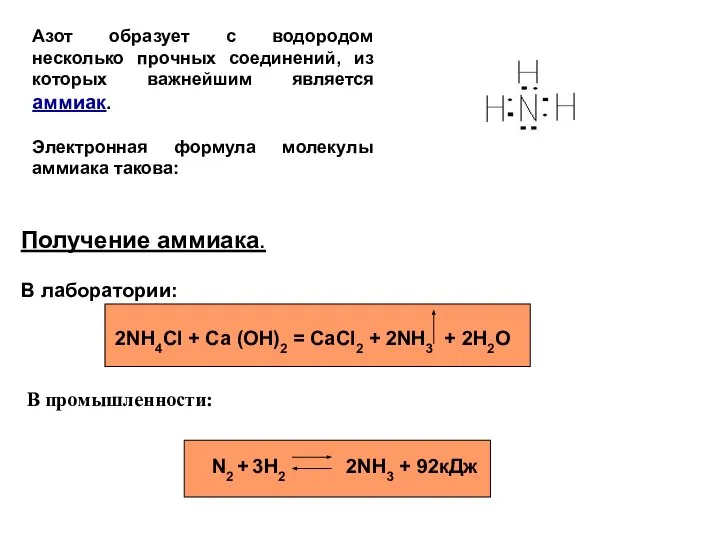
- 2. Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака
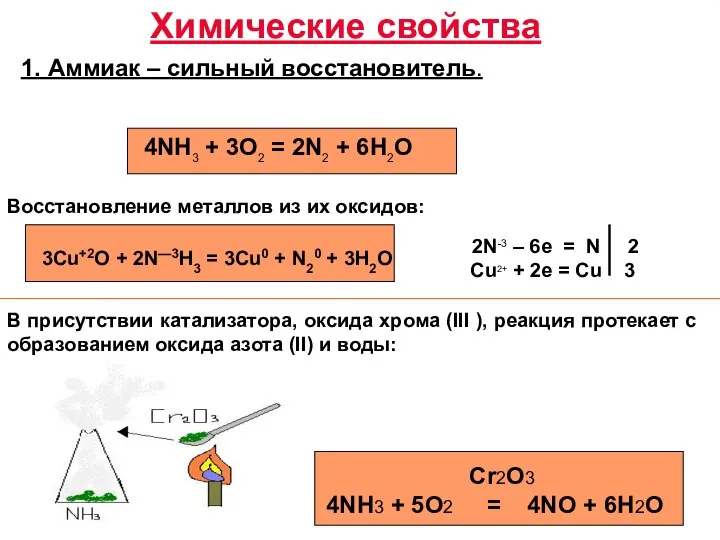
- 3. Химические свойства 1. Аммиак – сильный восстановитель. 3Cu+2O + 2N—3H3 = 3Cu0 + N20 + 3H2O
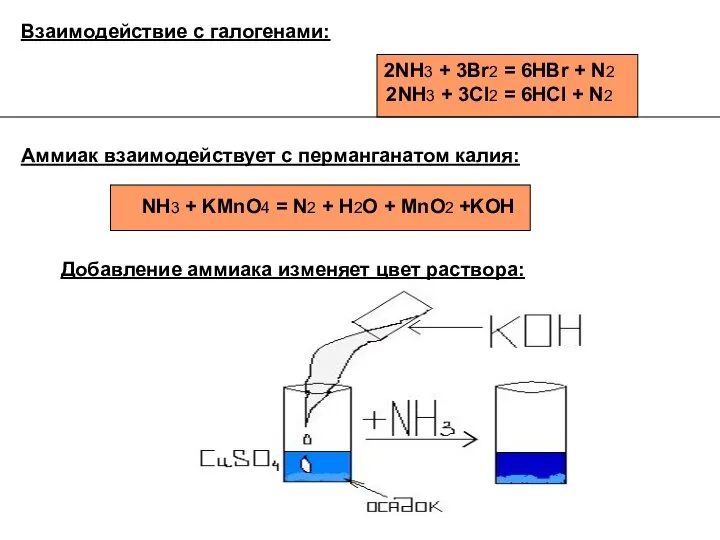
- 4. Аммиак взаимодействует с перманганатом калия: NH3 + KMnO4 = N2 + H2O + MnO2 +KOH Взаимодействие
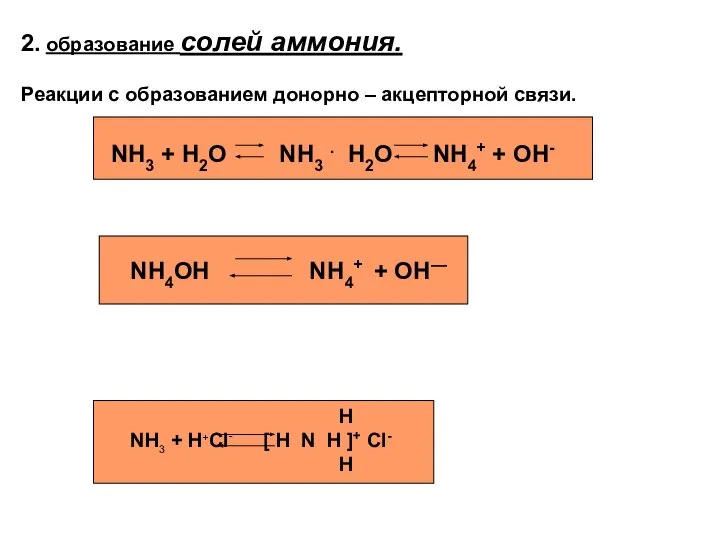
- 5. 2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH3 + H2O NH3 .
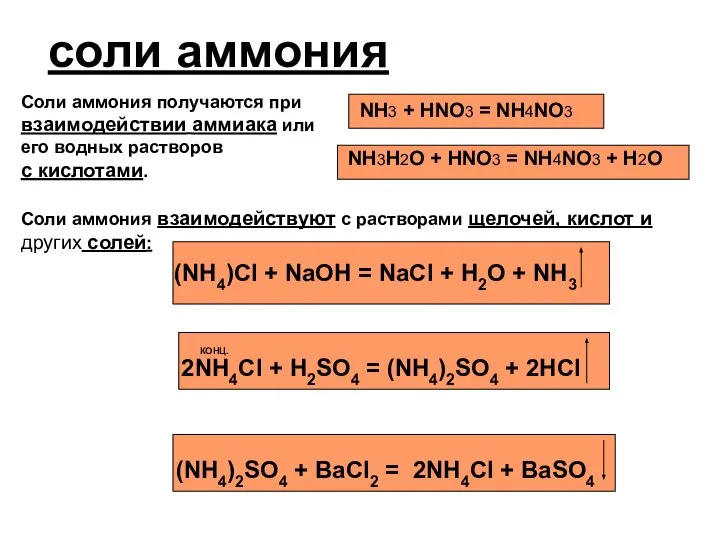
- 6. соли аммония Соли аммония получаются при взаимодействии аммиака или его водных растворов с кислотами. NH3 +
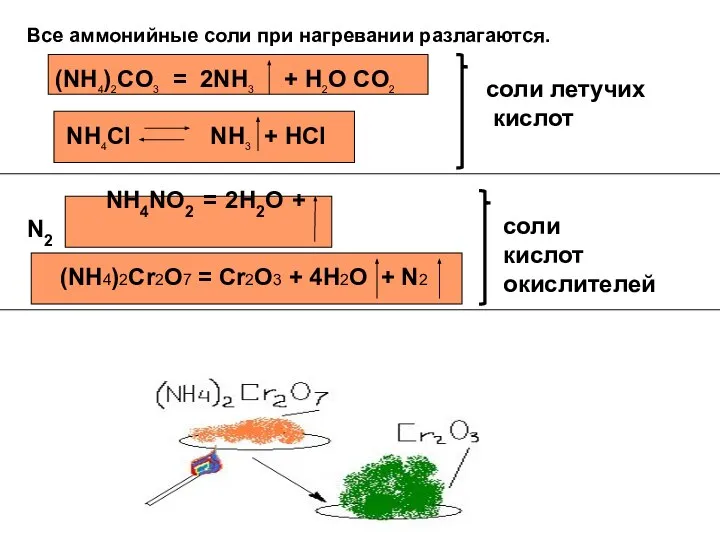
- 7. Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O CO2 NH4NO2 = 2H2O +
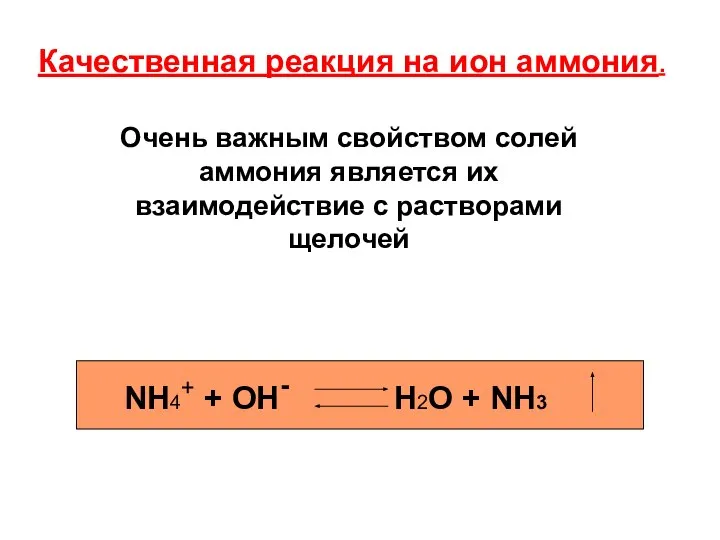
- 8. Качественная реакция на ион аммония. NH4+ + OH- H2O + NH3 Очень важным свойством солей аммония
- 9. Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N2O +2 NO +3 N2O3 +4
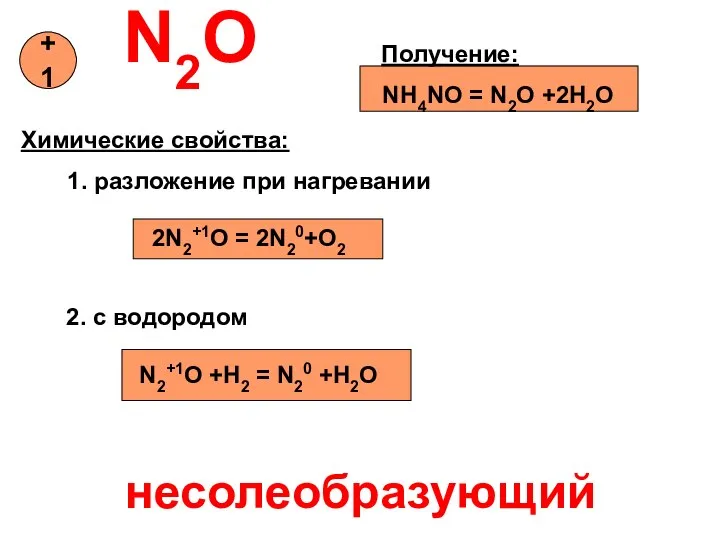
- 10. N2O Получение: NH4NO = N2O +2H2O Химические свойства: 1. разложение при нагревании 2N2+1O = 2N20+O2 2.
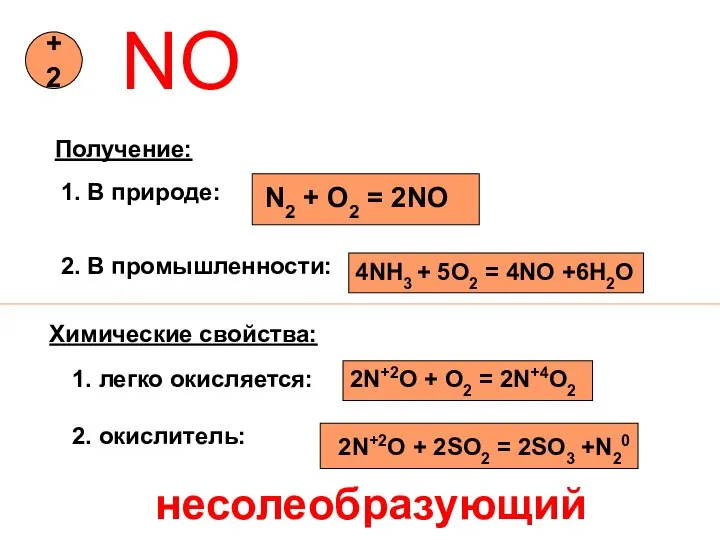
- 11. NO +2 Получение: 1. В природе: N2 + O2 = 2NO 2. В промышленности: 4NH3 +
- 12. N2O3 +3 Химические свойства: NO2 + NO N2O3 Получение: ВСЕ свойства кислотных оксидов. кислотный оксид
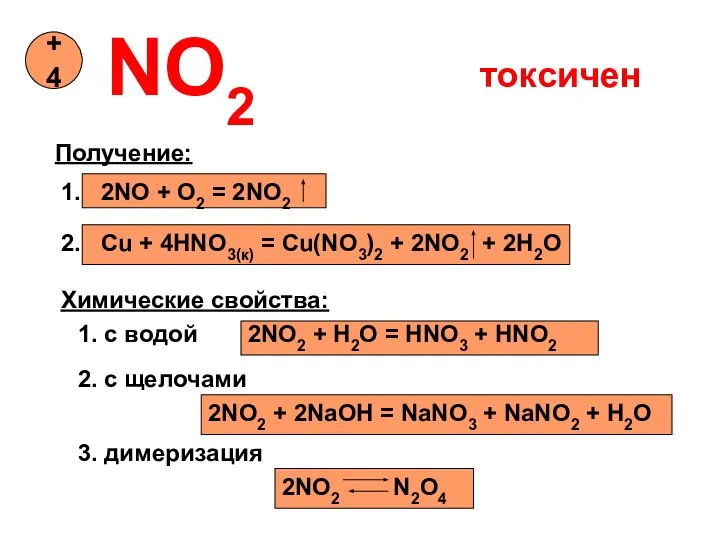
- 13. NO2 +4 Получение: 1. 2NO + O2 = 2NO2 2. Cu + 4HNO3(к) = Cu(NO3)2 +
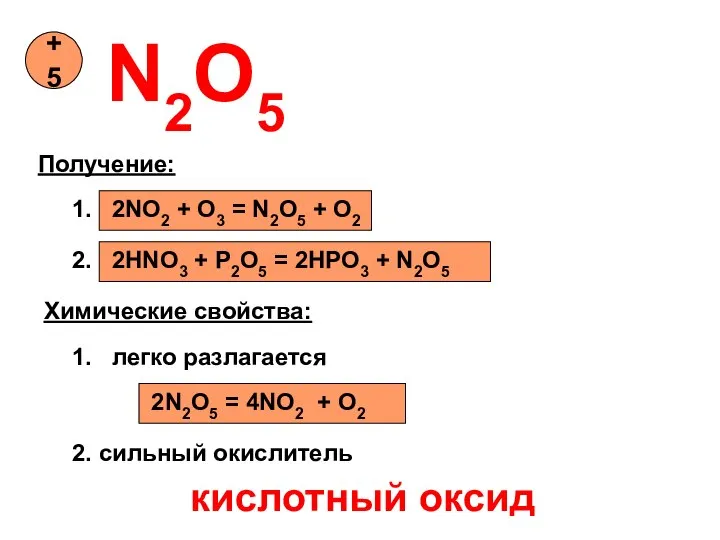
- 14. N2O5 +5 Получение: 1. 2NO2 + O3 = N2O5 + O2 2. 2HNO3 + P2O5 =
- 15. Азотная кислота. Получение азотной кислоты: KNO3 + H2SO4 = HNO3 + KHSO4 В лаборатории, при слабом
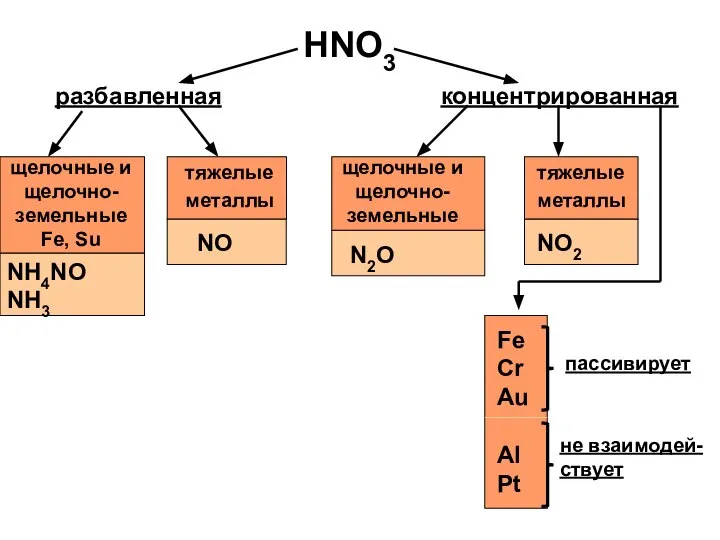
- 16. HNO3 разбавленная концентрированная щелочные и щелочно-земельные Fe, Su тяжелые металлы NH4NO NH3 NO щелочные и щелочно-земельные
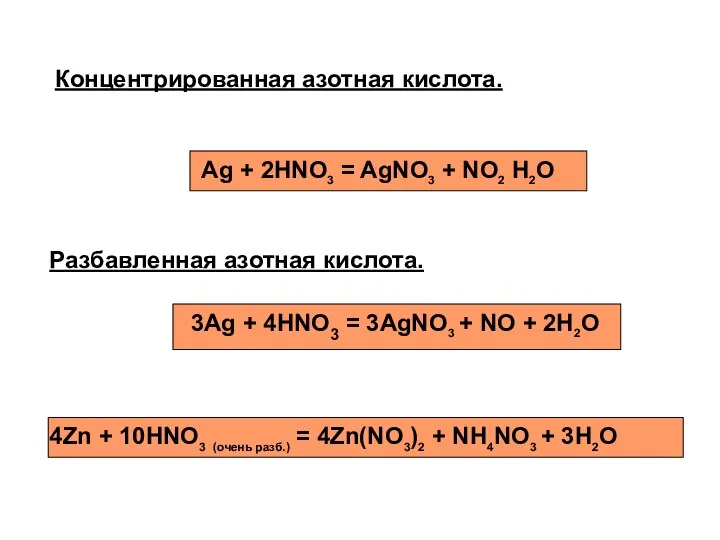
- 17. Разбавленная азотная кислота. Концентрированная азотная кислота. Ag + 2HNO3 = AgNO3 + NO2 H2O 3Ag +
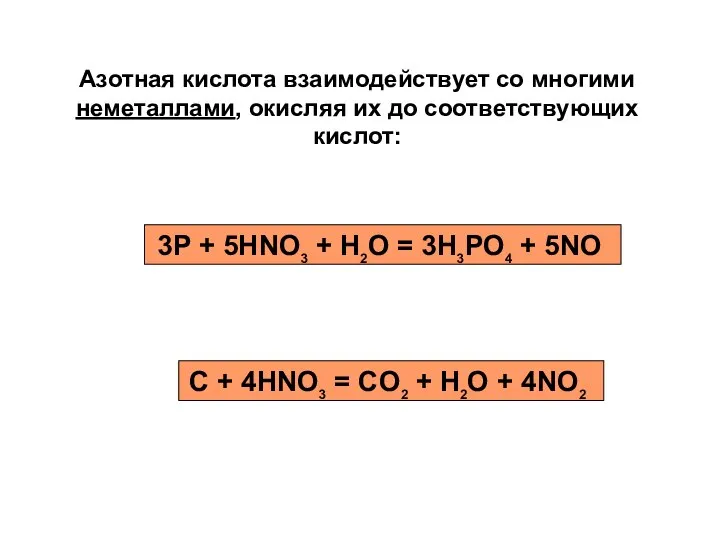
- 18. Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот: 3P + 5HNO3 + H2O
- 19. Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Селитры
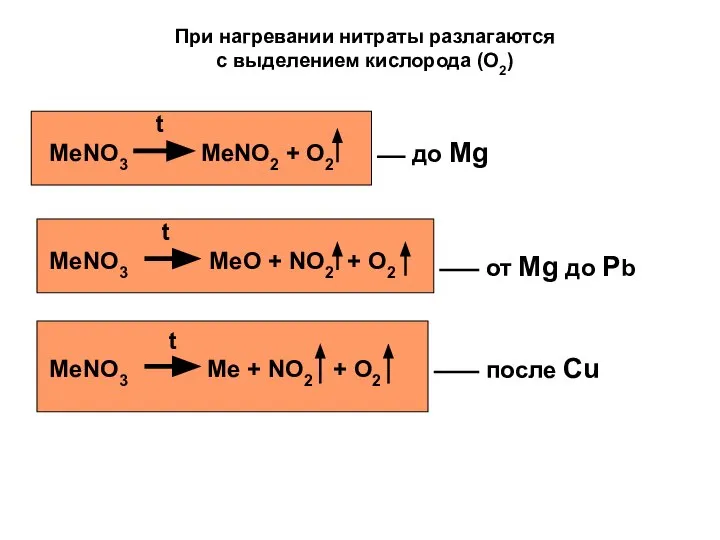
- 20. При нагревании нитраты разлагаются с выделением кислорода (O2) t MeNO3 MeNO2 + O2 t MeNO3 MeO
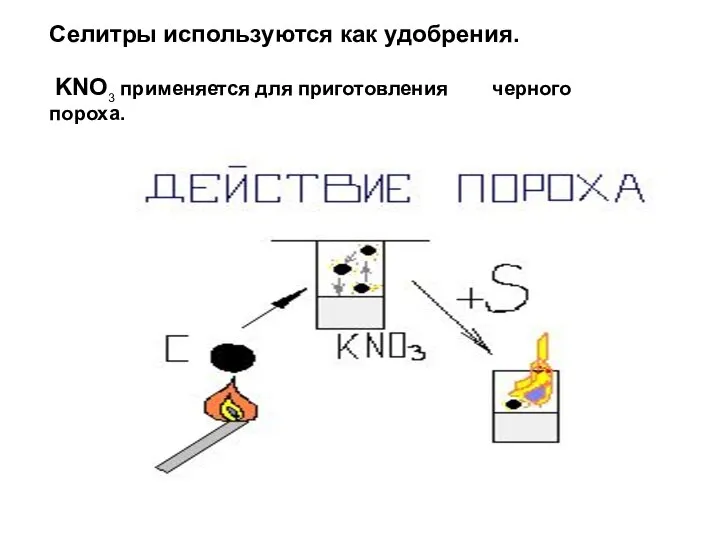
- 21. Селитры используются как удобрения. KNO3 применяется для приготовления черного пороха.
- 23. Скачать презентацию




 Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Классификация неорганических соединений
Классификация неорганических соединений Понятие биотехнологии
Понятие биотехнологии Химическая связь
Химическая связь Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства
Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства Вторичная переработка нефти. Крекинг
Вторичная переработка нефти. Крекинг Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении
Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Природные источники углеводородов
Природные источники углеводородов Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы
Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы Организация самостоятельной работы на уроках химии 8 класса с использованием электронного учебника
Организация самостоятельной работы на уроках химии 8 класса с использованием электронного учебника Изомерия, её виды
Изомерия, её виды Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Химический анализ воды
Химический анализ воды Строение и химические свойства глюкозы
Строение и химические свойства глюкозы Геохимический анализ поверхностных вод Звенигородской биостанции
Геохимический анализ поверхностных вод Звенигородской биостанции Презентация на тему Сера
Презентация на тему Сера  1.2. Измерения веществ
1.2. Измерения веществ Классификация белков
Классификация белков Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Основы химической термодинамики. Основные понятия химической термодинамики. Лекция 1
Основы химической термодинамики. Основные понятия химической термодинамики. Лекция 1 Интересные факты о меди
Интересные факты о меди Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Химия в рисунках или эта удивительная химия
Химия в рисунках или эта удивительная химия Термодинамика. Термодинамические потенциалы
Термодинамика. Термодинамические потенциалы Схема интеграции пентозофосфатного шунта с гликолизом
Схема интеграции пентозофосфатного шунта с гликолизом