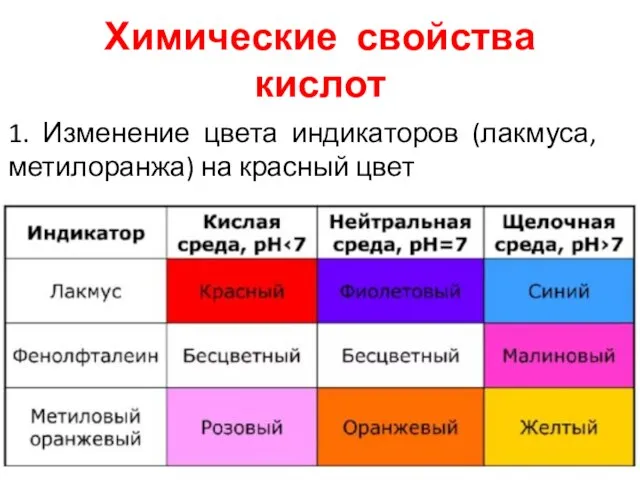
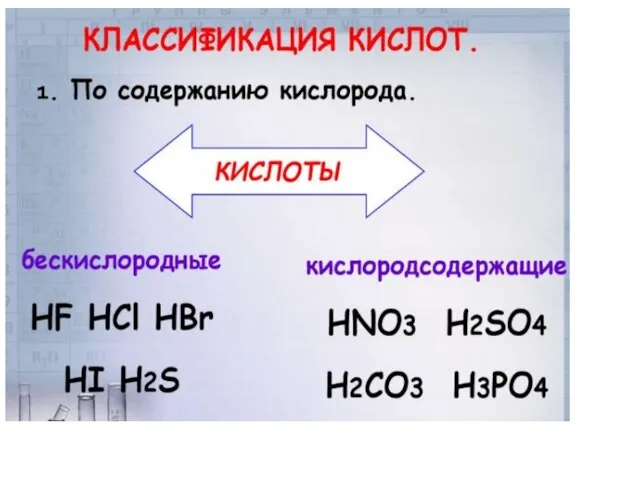
Слайд 7Химические свойства кислот
1. Изменение цвета индикаторов (лакмуса, метилоранжа) на красный цвет
Слайд 82. Кислота + металл (до Н) = соль + Н2

Слайд 93.Кислота + основный оксид = соль + Н2О
(оксид металла со ст.ок.≤3)

2HCl + CuO = CuCl2 + H2O
HCl + P2O5 /
H2SO4 + CrO3 /
Слайд 104.Кислота + Основание = соль + Н2О
Реакция между кислотой и основанием с

получением соли и воды называется реакцией НЕЙТРАЛИЗАЦИИ
HNO3 + NaOH (ф-ф) = NaNO3 + H2O
3HCl + Al(OH)3↓ = AlCl3 + 3H2O
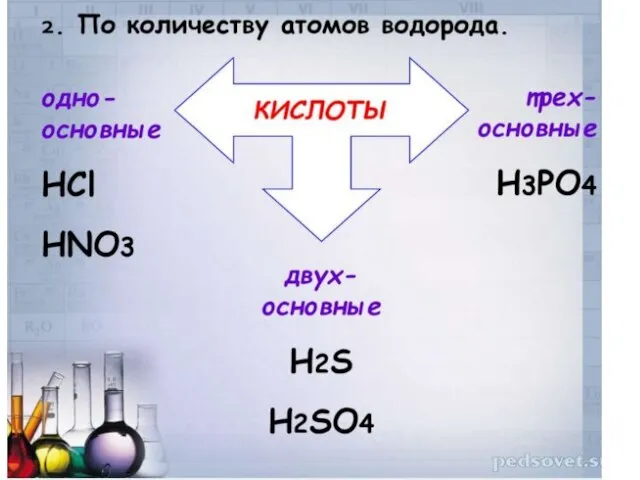
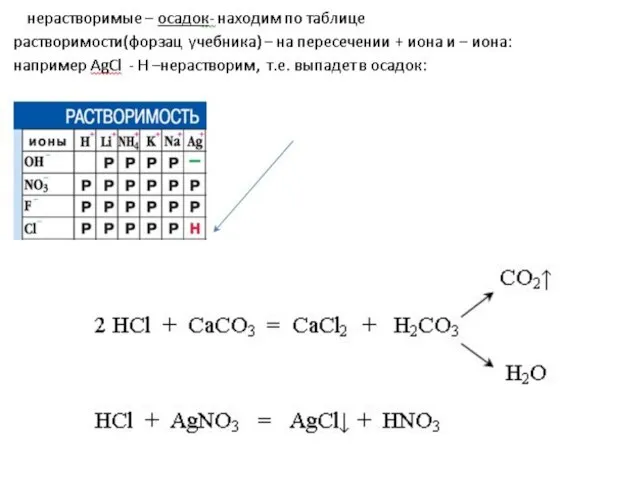
Слайд 115.Кислота + Соль = новая кислота + новая соль
Правило: Кислота реагирует с
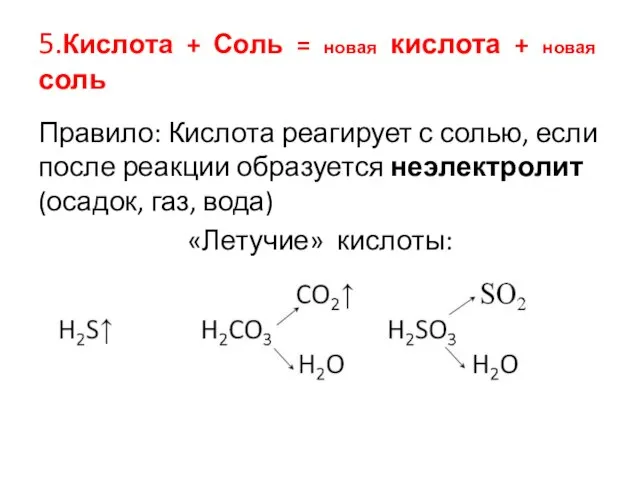
солью, если после реакции образуется неэлектролит (осадок, газ, вода)
«Летучие» кислоты:
Слайд 13Способы получения кислот
Кислотный оксид (кроме SiO2) + Н2О = Кислота
SO2 +

H2O = H2SO3
2. Кислота + Соль = новая соль + новая кислота
H2SO4 + BaCl2 = BaSO4↓ + 2 HCl
3. Водород + неметалл = кислота
H2 + S = H2S
Слайд 14Завершите запись тех уравнений реакций, которые будут происходить
H2SO4 + NaOH →
HCl

+ Cu →
HNO3 + SiO2 →
H3PO4 + CaCl2 →
HBr + Al →
Слайд 15HI + MgO →
HNO3 + Fe2(SO4)3 →
H2S + Pb(NO3)2 →
H2SiO3 + KCl
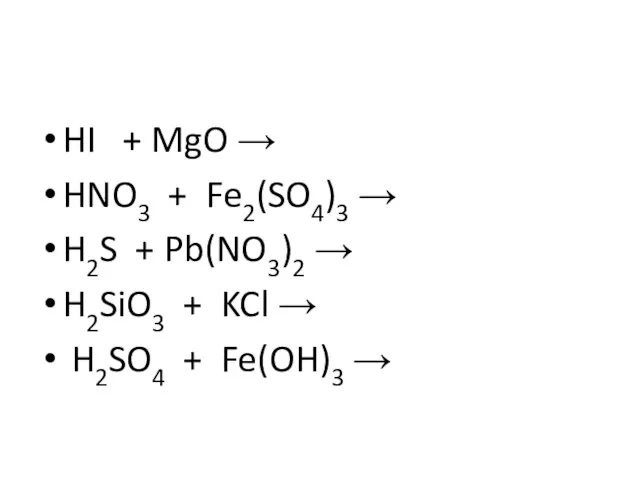
→
H2SO4 + Fe(OH)3 →










 Органические вещества
Органические вещества Модель Андерсона
Модель Андерсона Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)  Бордос сұйықтығын дайындау және оның сапасын тексеру
Бордос сұйықтығын дайындау және оның сапасын тексеру Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Теория валентных связей
Теория валентных связей Метаболизм липидов
Метаболизм липидов Методи визначення корозійної стійкості матеріалів (тема 11)
Методи визначення корозійної стійкості матеріалів (тема 11) Ионные уравнения
Ионные уравнения Биохимия крови
Биохимия крови Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Химическая связь в органических соединениях
Химическая связь в органических соединениях Спирты и фенолы
Спирты и фенолы Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Khim_8
Khim_8 Предельные одноатомные спирты
Предельные одноатомные спирты Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Презентация на тему по химии витамины
Презентация на тему по химии витамины  Астат. Свойства астата
Астат. Свойства астата Якісні реакції органічних речовин
Якісні реакції органічних речовин Степень окисления
Степень окисления Кетоны
Кетоны Сложные реакции
Сложные реакции Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Сходство химического состава клеток разных организмов как доказательство их родства
Сходство химического состава клеток разных организмов как доказательство их родства Свойства веществ
Свойства веществ Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP Применение алканов
Применение алканов