Слайд 2Хлороформ
Хлорофо́рм (он же трихлормета́н, метилтрихлори́д, хладо́н 20) — органическое химическое соединение с формулой CHCl3. При нормальных условиях бесцветная летучая жидкость c эфирным запахом и
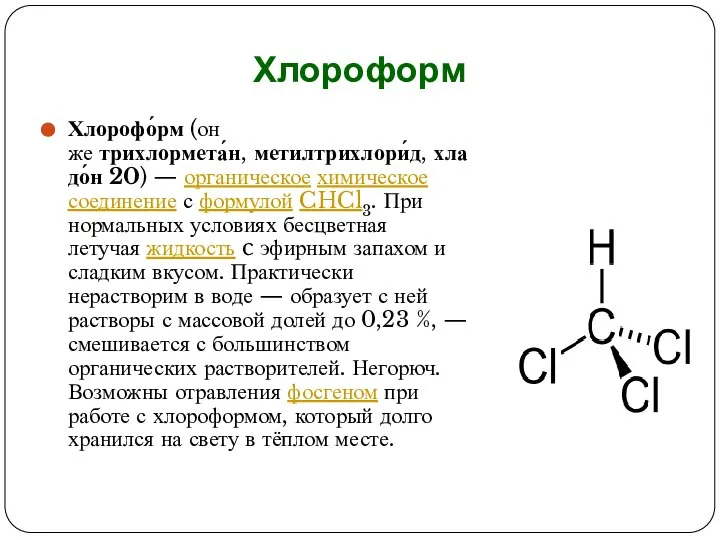
сладким вкусом. Практически нерастворим в воде — образует с ней растворы с массовой долей до 0,23 %, — смешивается с большинством органических растворителей. Негорюч. Возможны отравления фосгеном при работе с хлороформом, который долго хранился на свету в тёплом месте.
Слайд 3Физические свойства
Показатель преломления: 1,44858 при 15 °C.
Температура кристаллизации: −63,55 °C
Температура кипения: 61,152 °C
Дипольный момент: 1,15 дебая
Диэлектрическая

проницаемость: 4,806 при 20 °C
Слайд 4Получение
В промышленности хлороформ производят хлорированием метана или хлорметана. Реакционную смесь нагревают до температуры 400—500 °C. При этом

происходит серия химических реакций. Подобное происходит также при освещении смеси ультрафиолетом.
Результатом процесса является смесь, состоящая из метилхлорида, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется дистилляцией.
В лаборатории хлороформ можно получить также по реакции между ацетоном или этанолом и хлорной известью.
Поступающий в продажу хлороформ содержит этиловый спирт (1—2 %) в качестве стабилизатора, который связывает образующийся при длительном хранении на свету и в присутствии кислорода фосген. Хлороформ применяют в пробе Бейльштейна, в этой реакции наблюдается окрашивание пламени в голубовато-зелёный цвет ионами меди.
Слайд 5Применение
В конце XIX и начале XX веков хлороформ использовался как анестетик при проведении хирургических операций. Впервые как средство для

наркоза хлороформ был применён при хирургических операциях английским врачом Симпсоном (1848 г.). В России хлороформ как средство для наркоза впервые применил Н. И. Пирогов. Однако в данной роли хлороформ впоследствии был заменён более безопасными веществами.
Хлороформ также используется в качестве растворителя в фармакологической промышленности, а также для производства красителей и пестицидов. Хлороформ, содержащий дейтерий(CDCl3) — наиболее общий растворитель, используемый в ядерном магнитном резонансе (ЯМР).
Очистка
Процесс очистки делится на ряд этапов. Сперва хлороформ встряхивают с концентрированной серной кислотой, промывают водой, сушат над хлоридом кальция либо сульфатом магния и перегоняют. Проверить на чистоту хлороформ можно испарением с фильтровальной бумаги: после хлороформа не должно оставаться запаха. Затхлый, резкий, раздражающий запах говорит о наличии примесей хлора, хлороводорода или фосгена.
Воздействие на организм
Вдыхание хлороформа пагубно влияет на работу центральной нервной системы. Вдыхание воздуха с содержанием хлороформа порядка 0,09 % (900 ppm) за короткое время может вызвать головокружение, усталость и головную боль. Постоянное воздействие хлороформа может вызвать заболевания печени и почек. Приблизительно 10 % населения Земли имеюталлергическую реакцию на хлороформ, приводящую к повышению температуры тела (до 40 °C). Часто вызывает рвоту (частота послеоперационной рвоты достигала 75—80 %).
Слайд 6Иодоформ
(трииодметан) — жёлтое кристаллическое вещество с сильным характерным запахом, практически нерастворимое в воде.
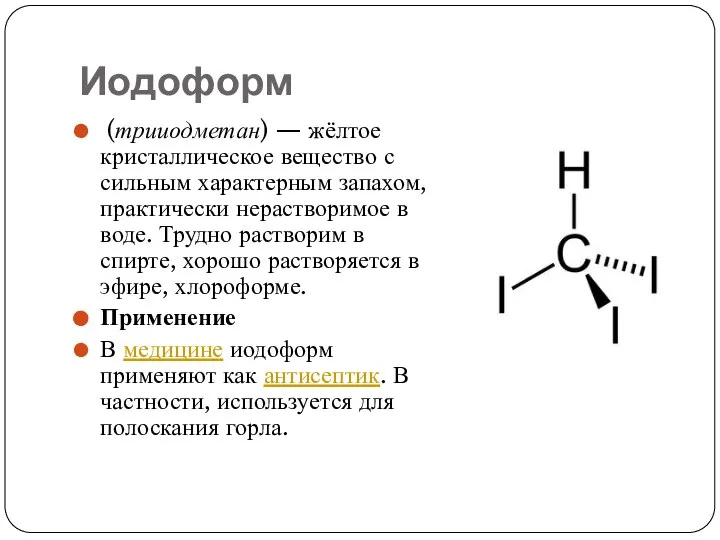
Трудно растворим в спирте, хорошо растворяется в эфире, хлороформе.
Применение
В медицине иодоформ применяют как антисептик. В частности, используется для полоскания горла.
Слайд 7Общие
Хим. формулаСНІ3
Физические свойства
Состояниежетлые кристаллы
Молярная масса393.73 г/моль
Плотность4.008 г/см³
Термические свойства
Т. плав.123 °C
Т. кип.217 °CХимические свойства
Растворимостьв воде0.1 г/л

Слайд 8Получение
Иодоформ получают из этанола или ацетона, действием йода и щелочей или карбонатов щелочных металлов:
6NaHCO3 + 4I2 + C2H5OH → CHI3↓ + HCOONa +

5NaI + 5H2O + 6CO2↑
Иодоформ также можно получить электролизом йодида калия или натрия в спиртовом растворе. При электролизе образуются йод и щелочь, необходимые для процесса. Образующийся при реакции йодид калия (натрия) снова подвергается электролизу, и, таким образом, весь йод соли идет на образование йодоформа.
Слайд 9Хлоральгидрат
(2,2,2-трихлорэтандиол-1,1) — бесцветные кристаллы, хорошо растворимые в воде, ацетоне, этаноле и диэтиловом эфире, малорастворимы в бензоле, пиридине и сероуглероде. Хлоральгидрат — продукт
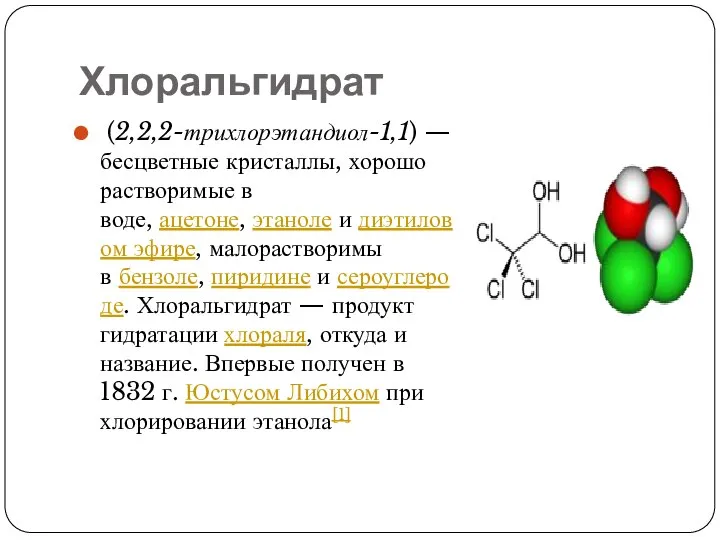
гидратации хлораля, откуда и название. Впервые получен в 1832 г. Юстусом Либихом при хлорировании этанола[1]
Слайд 10Медицинское применение[править | править вики-текст]
Хлоральгидрат (фармакопейное название —стал одним из первых синтетических снотворных и седативныхсредств: его физиологическое действие
![Медицинское применение[править | править вики-текст] Хлоральгидрат (фармакопейное название —стал одним из первых](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013863/slide-9.jpg)
было описано в 1869 г.[3], благодаря простоте синтеза и дешевизне он использовался в медицинской практике второй половины XIX — первой половины XX вв., после чего был в значительной степени вытеснен другими препаратами. Вместе с тем, хлоральгидрат до сих пор используется в медицинской практике и входит в список препаратов Всемирной Организации Здравоохранения, использующихся при анестезии[4].
Слайд 11Хим. формулаC2H3Cl3O2
Физические свойства
Бесцветные прозрачные кристаллы или мелкокристаллический порошок с характерным острым запахом

и слегка горьковатым своеобразным вкусом. Очень легко растворим в воде и спирте. На воздухе медленно улетучивается. Гигроскопичен.
Молярная масса165,41 г/моль
Плотность1,91 г/см³
Термические свойства
Т. плав.51,7 °C
Т. разл.98 °C
Химические свойства
Растворимость в вода (17 °C)470 г/100 мл
Растворимость в этанол (25 °C)77 г/100 мл
Растворимость в диэтиловый эфир (25 °C)66,5 г/100 мл
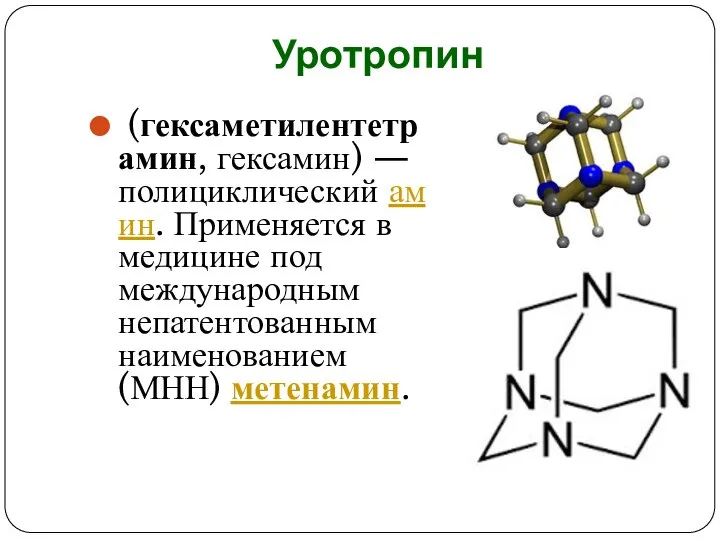
Слайд 12Уротропин
(гексаметилентетрамин, гексамин) — полициклический амин. Применяется в медицине под международным непатентованным наименованием (МНН) метенамин.
Слайд 13Получение и свойства
Впервые получен русским химиком А. М. Бутлеровым в 1859 году[1]. Образуется при

взаимодействии аммиака (4 моль) с формальдегидом (6 моль). Белое кристаллическое вещество, сублимируется при 270 °C. Легко растворим в воде, спирте, растворим в хлороформе, мало растворим в эфире.
Теплота сгорания 30,045 МДж/кг
Структурно подобен адамантану.
Крупнейшим производителем уротропина в России является губахинский ОАО «Метафракс».
Взаимодействует с перекисью водорода в присутствии лимонной кислоты или азотной кислоты с образованием гексаметилентрипероксиддиамина.
Слайд 14Применение
Производство полимеров
Применяется в производстве фенолформальдегидных смол.
Медицина
Основная статья: Метенамин
Гексаметилентетрамин — одно из немногих используемых в настоящее

время синтетических лекарственных средств с более чем 100-летней историей: он начал применяться на рубеже XIX—XX веков[2]. Препарат оказывает антисептический эффект, главным образом, в мочевых путях. Применяется в чистом виде и в составе комбинированных лекарственных средств (например, кальцекс). В чистом виде гексаметилентетрамин применяется перорально или внутривенно, в виде солей: гиппурата, индигокармината или камфората. Механизм действия основан на высвобождении свободного формальдегида, который денатурирует белки бактерий и обладает дубящим воздействием на кожу. Этим обусловлена тканевая специфичность действия гексаметилентетрамина и относительная безопасность препарата, так как он расщепляется с выделением активного формальдегида только в кислой среде[3] мочи, тем самым действуя непосредственно на бактерии, вызывающие заболевания мочевыводящих путей, а также в воспалительных очагах, богатых кислыми продуктами распада тканей. Эффект препарата дозозависим.
Слайд 15Пищевые добавки
В пищевой промышленности зарегистрирован как добавка-консервант (код E239). Часто применяется в сыроделии, а также для

консервации икры[4]. В России до 1 августа 2008 года числился среди «пищевых добавок, не оказывающих вредного воздействия на здоровье человека при использовании для изготовления пищевых продуктов»[5], с 1 июля 2010 года был запрещён[6]. Обладает сладковатым вкусом.
В быту[
Продаётся в пачках из десяти таблеток по 10 граммов каждая, или по 5 таблеток на 16 граммов под торговыми названиями «Сухое горючее», «Сухой спирт», «Разжигайка». Применяется в качестве горючего для приготовления (разогревания) пищи, для разжигания и прокаливания печей, прогревания погребов, гаражей и пр. (В качестве «сухого спирта» также может использоваться метальдегид).
Для придания влагостойкости пластифицирован твердыми нефтяными парафинами.
Другие сферы применения
в аналитической химии, как компонент буферных растворов и др.
в производстве взрывчатых веществ (сырье для производства гексогена) и гексаметилентрипероксиддиамина
в качестве ингибитора коррозии








![Медицинское применение[править | править вики-текст] Хлоральгидрат (фармакопейное название —стал одним из первых](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1013863/slide-9.jpg)





 Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Химический канцерогенез
Химический канцерогенез Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Явление когда один элемент образует несколько простых веществ - аллотропия
Явление когда один элемент образует несколько простых веществ - аллотропия Презентация на тему Этиловый спирт и его влияние на организм человека
Презентация на тему Этиловый спирт и его влияние на организм человека  Классификация углеводов
Классификация углеводов Презентация по Химии "Конструкции из стекла"
Презентация по Химии "Конструкции из стекла"  Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Платина
Платина Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Кислоты, соли
Кислоты, соли Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Растительные источники жиров и жирных масел
Растительные источники жиров и жирных масел Фундаментальные механизмы биохимической адаптации
Фундаментальные механизмы биохимической адаптации Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Полиэтилен. Получение полиэтилена
Полиэтилен. Получение полиэтилена Щелочные металлы
Щелочные металлы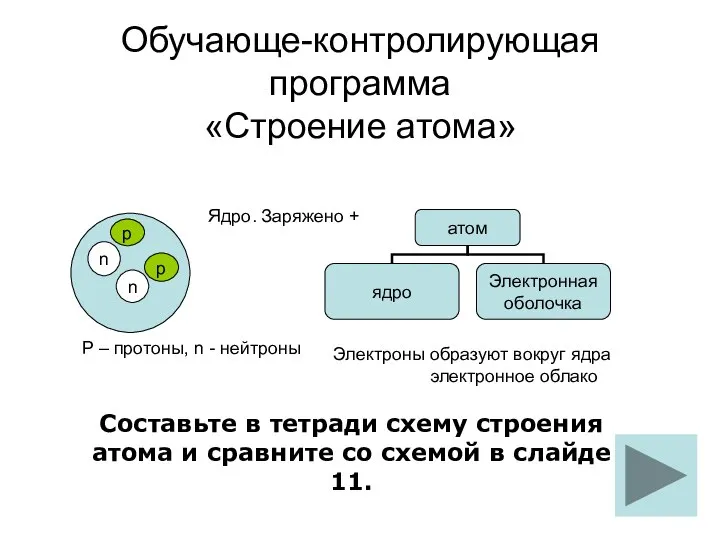 строение атома обуч-контр прогр
строение атома обуч-контр прогр Logo кроссворд первоначальные понятия. 8 класс
Logo кроссворд первоначальные понятия. 8 класс Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Изомерия. Виды изомерии
Изомерия. Виды изомерии КВН по теме: Периодическая система химических элементов Д.И. Менделеева
КВН по теме: Периодическая система химических элементов Д.И. Менделеева Презентация по химии. Спирты, их свойства и применение.
Презентация по химии. Спирты, их свойства и применение. Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Классификация органических соединений. 10 класс
Классификация органических соединений. 10 класс