Содержание
- 2. Основные понятия Химическая термодинамика рассматривает энергетические аспекты различных процессов и определяет условия их самопроизвольного протекания.
- 3. Системой называют отдельное тело или группу тел, фактически или мысленно отделенных от окружающей среды. Окружающая среда
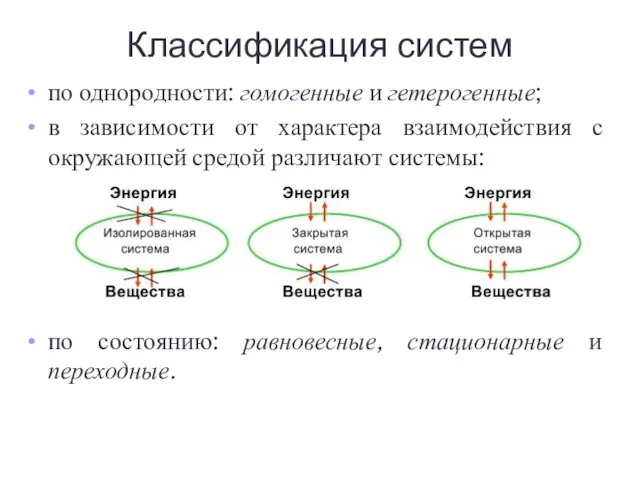
- 4. по однородности: гомогенные и гетерогенные; в зависимости от характера взаимодействия с окружающей средой различают системы: по
- 5. Т/д равновесное состояние характеризуется постоянством всех свойств во времени и отсутствием потока вещества и энергии в
- 6. Совокупность всех физических и химических свойств системы называют состоянием системы. Его характеризуют термодинамическими параметрами, которые бывают:
- 7. Термодинамические процессы Если в системе в течение некоторого времени изменяется хотя бы один из термодинамических параметров,
- 8. Внутренняя энергия Внутренняя энергия (U) характеризует общий запас энергии системы. Она включает все виды энергии движения
- 9. Теплота и работа Теплота (Q) - неупорядоченный (хаотический) вид передачи энергии. Работа (W) - упорядоченный (организованный)
- 10. Первое начало термодинамики
- 11. Формулировки 1.Энергия не исчезает бесследно и не возникает из ничего, переход ее из одного вида в
- 12. Математический вид: Q=ΔU + W= ΔU + pΔV, Количество теплоты, подведенное к системе, идет на изменение
- 13. Первый закон термодинамики в применении к некоторым процессам 1. Изотермические процессы. Т = const. Q=ΔU +
- 14. Закон Гесса
- 15. Следствия из закона Гесса. 1. ΔНr 298 =∑νiΔ H0f 298(прод) -∑ νiΔH0f 298(исх) Стандартной энтальпией образования
- 16. 2. ΔНr 298 =∑νiΔ H0f 298(исх) -∑νi ΔH0f 298(прод) Стандартной энтальпией сгорания называют изменение энтальпии в
- 17. Второе начало термодинамики
- 18. I закон термодинамики дает данные лишь о тепловыделении и говорит о превращении одной формы энергии в
- 19. Новая функция состояния: энтропия (S, Дж/моль·К) – мера беспорядка системы. Является критерием направленности процессов в изолированной
- 21. Скачать презентацию

















 Простые вещества - неметаллы
Простые вещества - неметаллы Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии  Кислоты
Кислоты Свойства воды
Свойства воды Металдар мен қорытпалардың құрылысы және қасиеттері
Металдар мен қорытпалардың құрылысы және қасиеттері Кремнийорганические каучуки
Кремнийорганические каучуки Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Презентация на тему Водород, его общая характеристика, нахождение в природе и его свойства
Презентация на тему Водород, его общая характеристика, нахождение в природе и его свойства  Химическая мозаика
Химическая мозаика Амины. Номенклатура
Амины. Номенклатура Реакции обмена
Реакции обмена Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Химический анализ растворов этилового спирта черной смородины
Химический анализ растворов этилового спирта черной смородины Презентация на тему Основные химические понятия
Презентация на тему Основные химические понятия  Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь
Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь Металлы. Группы металлов
Металлы. Группы металлов Презентация на тему Фосфор
Презентация на тему Фосфор  Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Свойства растворов электролитов
Свойства растворов электролитов Химическая технология органических веществ
Химическая технология органических веществ 3_Kislorodsoderzhaschie_kisloty_khlora
3_Kislorodsoderzhaschie_kisloty_khlora Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств
Свойства отдельных классов неорганических и органических веществ на примере лекарственных средств Криогенный разрыв пласта
Криогенный разрыв пласта Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки
Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки Химия природная или синтетическая
Химия природная или синтетическая Кристаллическое состояние полимеров
Кристаллическое состояние полимеров Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Оксидтер мен негіздердің реакциялары
Оксидтер мен негіздердің реакциялары