данные превращения:
C → CH4 → CO2 → H2CO3 → K2CO3 → CaCO3
Укажите типы написанных реакций (если возможно) по следующим признакам классификации:
По фазовому составу
По использованию катализатора
По направлению
По тепловому эффекту
По числу и составу реагирующих и образующихся веществ;
*Реакции ионного обмена рассмотрите в полном и сокращенном ионном виде
По признаку изменения степеней окисления атомов элементов;
*В ОВР расставьте коэффициенты методом электронного баланса
ВАРИАНТ №2
1. Напишите уравнения реакций, с помощью которых можно осуществить данные превращения:
Mg → MgO → Mg(OH)2 → Mg(NO3)2 → Mg3(PO4)2
↓
MgSO4
Укажите типы написанных реакций (если возможно) по следующим признакам классификации:
По фазовому составу
По использованию катализатора
По направлению
По тепловому эффекту
По числу и составу реагирующих и образующихся веществ;
*Реакции ионного обмена рассмотрите в полном и сокращенном ионном виде
По признаку изменения степеней окисления атомов элементов;
*В ОВР расставьте коэффициенты методом электронного баланса
















 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Эмпирические правила
Эмпирические правила Получение галогеноалканов
Получение галогеноалканов Алканы 10-класс
Алканы 10-класс Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Понятие о спиртах
Понятие о спиртах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Классификация неорганических соединений
Классификация неорганических соединений Химические уравнения
Химические уравнения Водород. Вода
Водород. Вода Атомы химических элементов
Атомы химических элементов Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Предмет органической химии
Предмет органической химии Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Классификация методов аналитической химии
Классификация методов аналитической химии Химическая связь
Химическая связь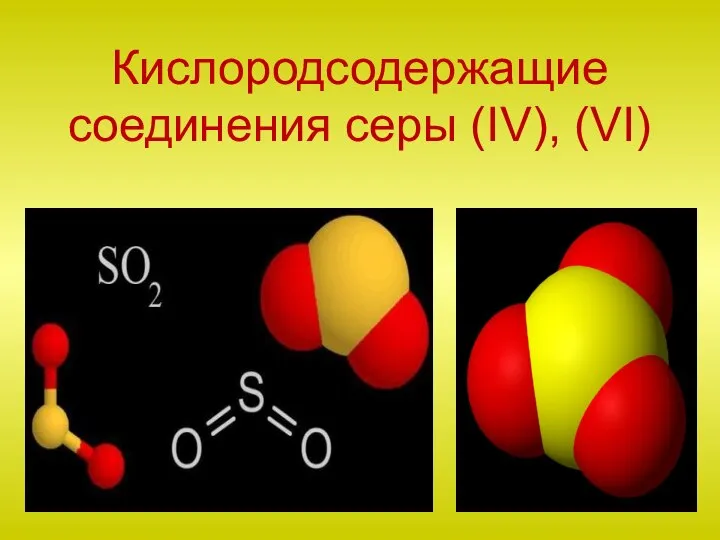 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Алкены
Алкены Поликарбонат мономерлері
Поликарбонат мономерлері Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Железо и его соединения
Железо и его соединения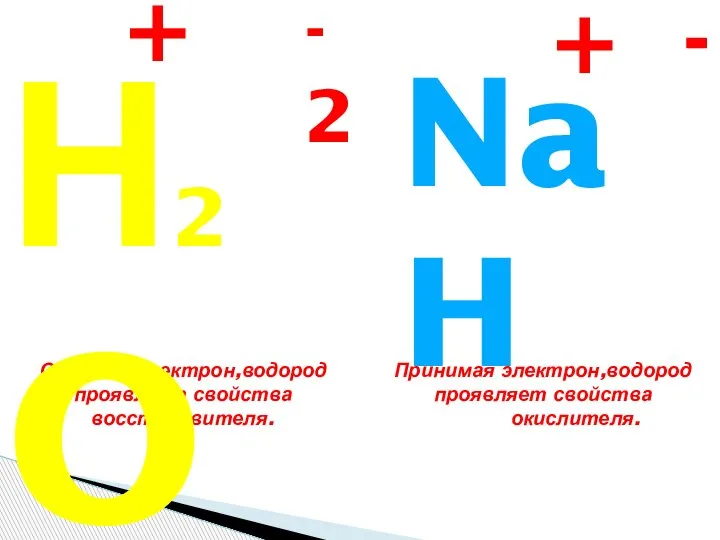 Кислород и водород
Кислород и водород Электролитическая диссоциация
Электролитическая диссоциация Метод валентных связей
Метод валентных связей