Слайд 2Се́ра — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI

группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Слайд 3В ПРИРОДЕ ЧАСТО ВСТРЕЧАЮТСЯ ЗНАЧИТЕЛЬНЫЕ ЗАЛЕЖИ СЕРЫ (БОЛЬШЕЙ ЧАСТЬЮ ВБЛИЗИ ВУЛКАНОВ). НАИБОЛЕЕ

ЧАСТО ВСТРЕЧАЮЩИЕСЯ СУЛЬФИДЫ: ЖЕЛЕЗНЫЙ КОЛЧЕДАН (ПИРИТ) FES2, МЕДНЫЙ КОЛЧЕДАН CUFES2, СВИНЦОВЫЙ БЛЕСК PBS И ЦИНКОВАЯ ОБМАНКА ZNS. ЕЩЕ ЧАЩЕ СЕРА ВСТРЕЧАЕТСЯ В ВИДЕ СУЛЬФАТОВ, НАПРИМЕР СУЛЬФАТ КАЛЬЦИЯ (ГИПС И АНГИДРИТ), СУЛЬФАТ МАГНИЯ (ГОРЬКАЯ СОЛЬ И КИЗЕРИТ), СУЛЬФАТ БАРИЯ (ТЯЖЕЛЫЙ ШПАТ), СУЛЬФАТ СТРОНЦИЯ (ЦЕЛЕСТИН), СУЛЬФАТ НАТРИЯ (ГЛАУБЕРОВА СОЛЬ).
КРОМЕ ТОГО, СЕРА ПРИСУТСТВУЕТ В НЕФТИ, ПРИРОДНОМ УГЛЕ, ПРИРОДНЫХ ГАЗАХ, В ПРИРОДНЫХ ВОДАХ (В ВИДЕ СУЛЬФАТ-ИОНА И ОБУСЛАВЛИВАЕТ «ПОСТОЯННУЮ» ЖЁСТКОСТЬ ПРЕСНОЙ ВОДЫ). ЖИЗНЕННО ВАЖНЫЙ ЭЛЕМЕНТ ДЛЯ ВЫСШИХ ОРГАНИЗМОВ, СОСТАВНАЯ ЧАСТЬ МНОГИХ БЕЛКОВ, КОНЦЕНТРИРУЕТСЯ В ВОЛОСАХ.
Слайд 4Соединение серы
ДЛЯ СЕРЫ ХАРАКТЕРНО НАЛИЧИЕ ТРЕХ СТЕПЕНЕЙ ОКИСЛЕНИЯ «-2», «+4» И «+6».
ДЛЯ
ПОЛУЧЕНИЯ СЕРЫ ИСПОЛЬЗУЮТ РЕАКЦИЮ ВАКЕНРОДЕРА (1) ИЛИ ПОЛУЧАЮТ ЕЕ НЕПОЛНЫМ ОКИСЛЕНИЕМ СЕРОВОДОРОДА (2):
2H2S + SO2 = 3S↓ + 2H2O (1)
H2S + O2 = 2S↓ + 2H2O (2)
Слайд 5Химические свойства серной кислоты
СЕРНАЯ КИСЛОТА – ОДНА ИЗ САМЫХ СИЛЬНЫХ МИНЕРАЛЬНЫХ КИСЛОТ,

ИЗ-ЗА ВЫСОКОЙ ПОЛЯРНОСТИ СВЯЗЬ Н – О ЛЕГКО РАЗРЫВАЕТСЯ.
В ВОДНОМ РАСТВОРЕ СЕРНАЯ КИСЛОТА ДИССОЦИИРУЕТ, ОБРАЗУЯ ИОН ВОДОРОДА И КИСЛОТНЫЙ ОСТАТОК:
H2SO4 = H+ + HSO4-;
HSO4- = H+ + SO42-.
СУММАРНОЕ УРАВНЕНИЕ:
H2SO4 = 2H+ + SO42-.
Слайд 6Кислотные дожди
В РЕЗУЛЬТАТЕ РАЗВИТИЯ ПРОМЫШЛЕННОСТИ И ТЕХНОЛОГИЙ ЗАВОДЫ, ФАБРИКИ И РАЗЛИЧНЫЕ ПРЕДПРИЯТИЯ

СТАЛИ ВЫБРАСЫВАТЬ В ВОЗДУХ ОГРОМНОЕ КОЛИЧЕСТВО ОКСИДОВ НИТРОГЕНА И СУЛЬФУРА. ТАК, КОГДА СЕРА ПОПАДАЕТ В АТМОСФЕРУ, ОНА ВЗАИМОДЕЙСТВУЕТ С ПАРАМИ ВОДЫ, ОБРАЗУЕТСЯ СЕРНАЯ КИСЛОТА. ТОЖЕ ПРОИСХОДИТ И С ДВУОКИСЬЮ АЗОТА, ОБРАЗУЕТСЯ АЗОТНАЯ КИСЛОТА, ВЫПАДАЕТ ВМЕСТЕ С АТМОСФЕРНЫМИ ОСАДКАМИ.





 Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Клеящие материалы
Клеящие материалы Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Презентация на тему Озоновая дыра
Презентация на тему Озоновая дыра  Влияние бытовой химии на здоровье человека
Влияние бытовой химии на здоровье человека Аммиак. Строение молекулы. Водородная связь
Аммиак. Строение молекулы. Водородная связь Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Виды химической связи и типы кристаллических решеток
Презентация на тему Виды химической связи и типы кристаллических решеток 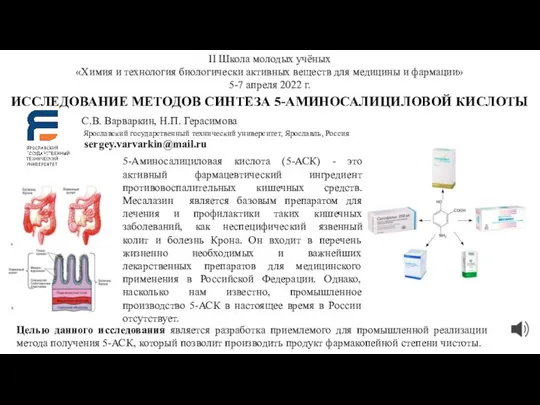 Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Расчет печи кипящего слоя в производстве хлорида калия
Расчет печи кипящего слоя в производстве хлорида калия Арены. Бензол
Арены. Бензол Предмет органическая химия. Теория строения органических веществ
Предмет органическая химия. Теория строения органических веществ Химическая связь. Строение вещества
Химическая связь. Строение вещества Полімери. Пінополістирол
Полімери. Пінополістирол Полимеры и пластмассы
Полимеры и пластмассы Гидролиз солей
Гидролиз солей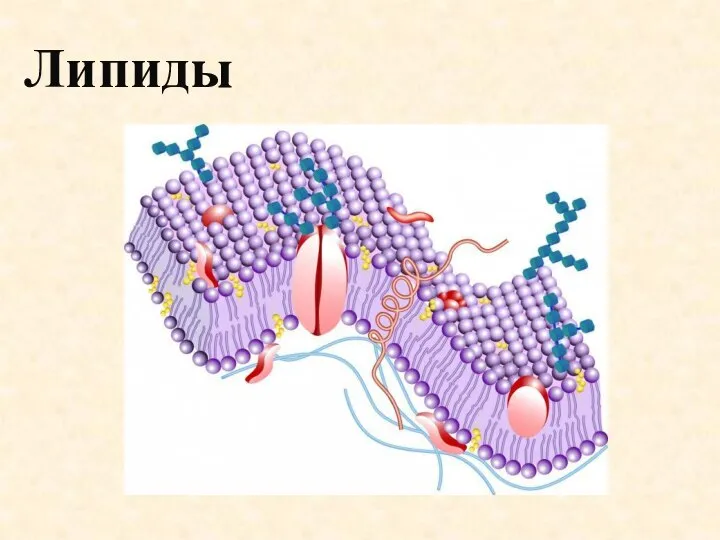 Липиды. Источники
Липиды. Источники Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Системно-деятельностный подход в обучении химии
Системно-деятельностный подход в обучении химии Кремний и его соединения
Кремний и его соединения Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Поликонденсация. Особенности процесса
Поликонденсация. Особенности процесса Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Предельные углеводороды. Тест 19
Предельные углеводороды. Тест 19 Круговорот азота в природе
Круговорот азота в природе Разбор домашнего задания
Разбор домашнего задания