Содержание
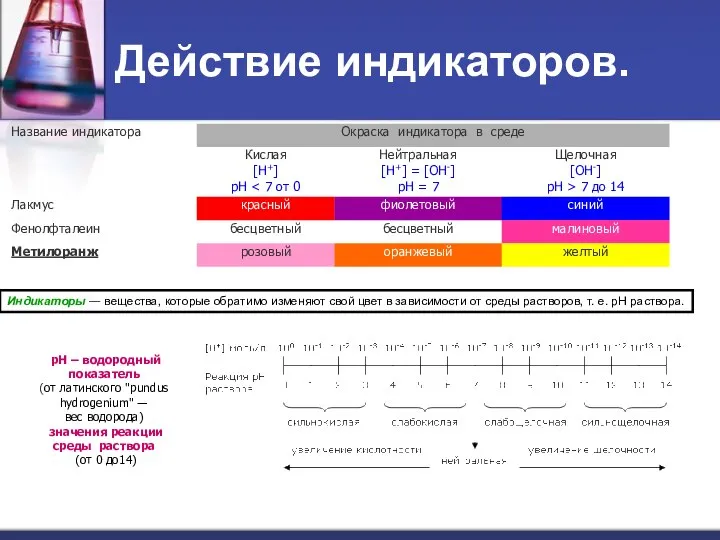
- 2. Действие индикаторов. рН – водородный показатель (от латинского "pundus hydrogenium" ― вес водорода) значения реакции среды
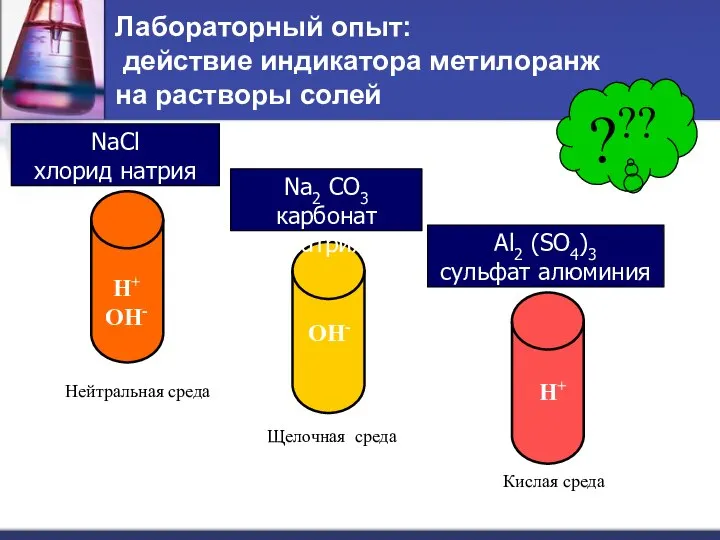
- 3. Лабораторный опыт: действие индикатора метилоранж на растворы солей ??? Na2 CO3 карбонат натрия NaCl хлорид натрия
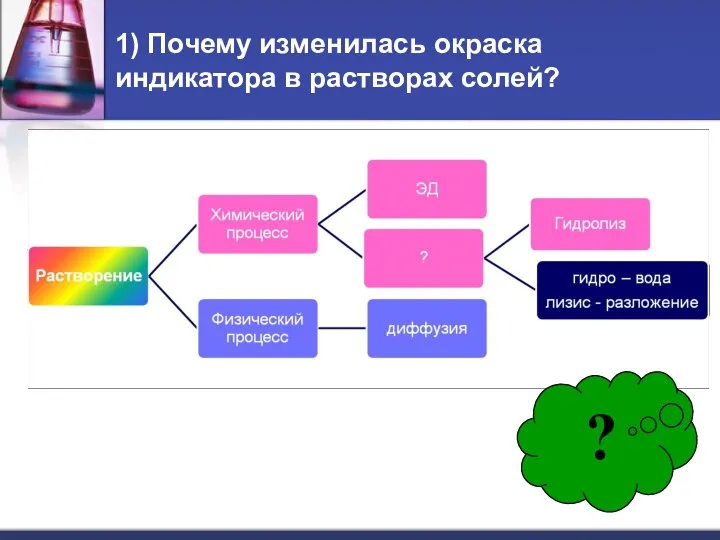
- 4. 1) Почему изменилась окраска индикатора в растворах солей? ?
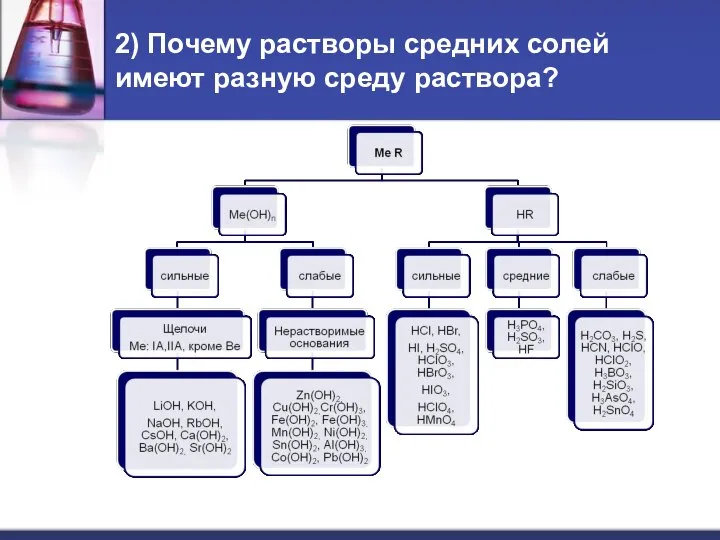
- 5. 2) Почему растворы средних солей имеют разную среду раствора?
- 6. Схема гидролиза сульфата алюминия Al(OH)3 H2SO4 слабое основание сильная кислота [OH]- (что сильней того и больше!)
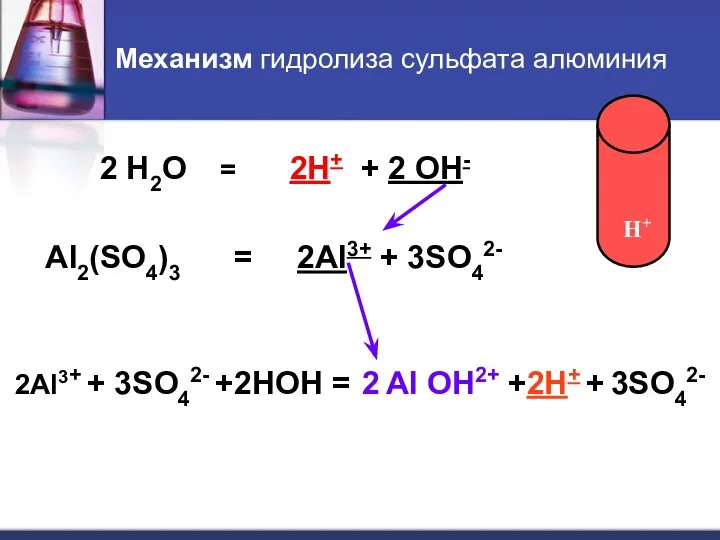
- 7. Механизм гидролиза сульфата алюминия 2 H2O = 2H+ + 2 OH- Al2(SO4)3 = 2Al3+ + 3SO42-
- 8. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ 1. Определяем тип гидролиза. Составляем уравнение ЭД соли: Al2(SO4)3 =
- 9. Сформулируем вывод: Соли, образованные сильн___________ и слаб____________ гидролизируют по ________________ с образованием ___________________ и _______________, обуславливающих
- 10. Сформулируем вывод: Соли, образованные сильной кислотой и слабым основанием гидролизируют по катиону с образованием гидроксокатионов и
- 11. Схема гидролиза карбоната натрия NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того
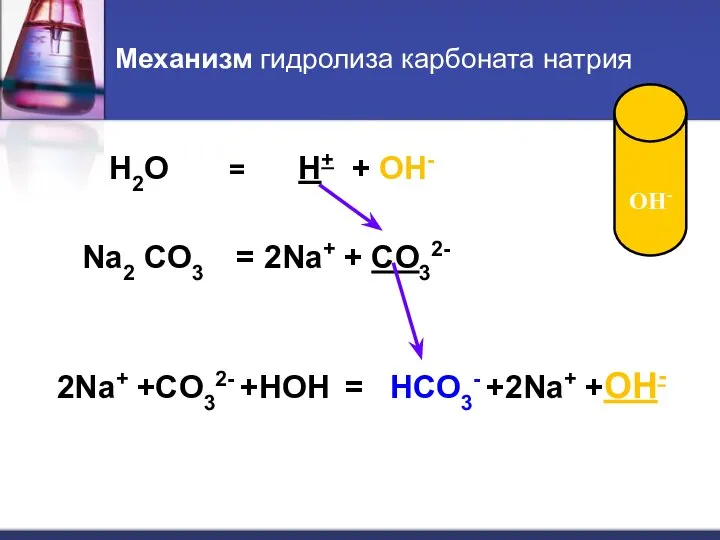
- 12. Механизм гидролиза карбоната натрия H2O = H+ + OH- Na2 CO3 = 2Na+ + CO32- 2Na+
- 13. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ 1. Определяем тип гидролиза. Составляем уравнение ЭД соли: Na2 CO3
- 14. Сформулируем вывод: Соли, образованные сильн___________ и слаб____________ гидролизируют по ________________ с образованием ___________________ и _______________, обуславливающих
- 15. Сформулируем вывод: Соли, образованные сильным основанием и слабой кислотой гидролизируют по аниону с образованием гидроанионов и
- 16. Схема гидролиза хлорида натрия NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й
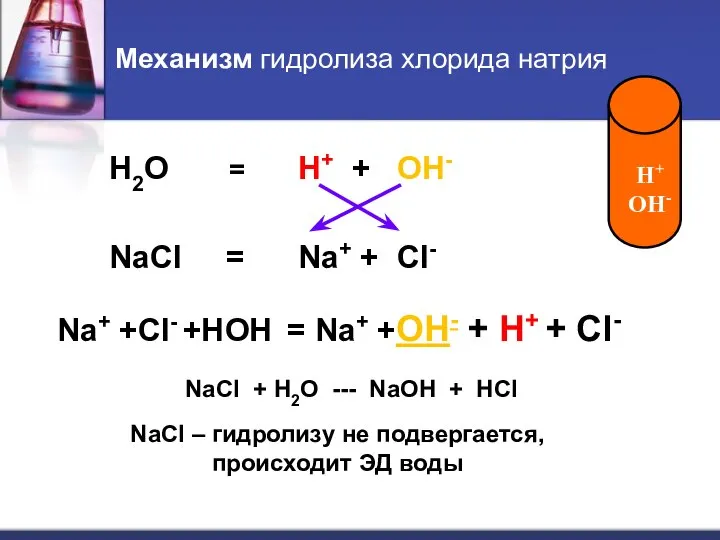
- 17. Механизм гидролиза хлорида натрия H2O = H+ + OH- NaCl = Na+ + Cl- Na+ +Cl-
- 18. Сформулируем вывод: Соли, образованные сильным основанием и сильным кислотой Не гидролизируют. Происходит ЭД воды, обуславливающая нейтральную
- 19. Схема гидролиза сульфида алюминия Al(OH)3 H2S слабое основание слабая кислота [OH]- = [H]+ Н е й
- 20. Сформулируем вывод: Соли, образованные ___________ и ____________ гидролизируют по ________________ с образованием ___________________ и _______________, обуславливающих
- 21. Сформулируем вывод: Соли, образованные слабой кислотой и слабым основанием гидролизируют одновременно по аниону и катиону с
- 22. Сформулируем определение понятия «гидролиз»: К какому типу мы отнесем данные реакции? Какие вещества в них участвуют?
- 23. Закрепление: самостоятельно заполните таблицу на основе эксперимента
- 24. Закрепление: проверка.
- 25. Роль гидролиза в природе: Преобразование земной коры Обеспечение слабощелочной среды морской воды Роль гидролиза в повседневной
- 27. Скачать презентацию
![Схема гидролиза сульфата алюминия Al(OH)3 H2SO4 слабое основание сильная кислота [OH]- (что](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1075223/slide-5.jpg)



![Схема гидролиза карбоната натрия NaOH H2CO3 сильное основание слабая кислота [OH]- >](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1075223/slide-10.jpg)



![Схема гидролиза хлорида натрия NaOH HCl сильное основание сильная кислота [OH]- =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1075223/slide-15.jpg)

![Схема гидролиза сульфида алюминия Al(OH)3 H2S слабое основание слабая кислота [OH]- =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1075223/slide-18.jpg)






 Оксиды. Классификация, химические и физические свойства
Оксиды. Классификация, химические и физические свойства Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия Презентация на тему Гидролиз
Презентация на тему Гидролиз  Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Органические вещества. 9 класс
Органические вещества. 9 класс Гибридизация АО. Пространственное строение молекул (геометрия молекул)
Гибридизация АО. Пространственное строение молекул (геометрия молекул) Приемы разделения мембранных липидов на классы
Приемы разделения мембранных липидов на классы Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Изомерия. Виды изомерии
Изомерия. Виды изомерии Классы неорганических веществ. Типы химических реакций Конкурс знаний
Классы неорганических веществ. Типы химических реакций Конкурс знаний Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Неорганические вещества
Неорганические вещества Методы диагностики плазмы
Методы диагностики плазмы Практическая работа: наблюдение роста кристалов
Практическая работа: наблюдение роста кристалов Реакции разложения и соединения
Реакции разложения и соединения Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Агрегатные состояния вещества
Агрегатные состояния вещества Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс
Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях Химия в быту
Химия в быту АЛЬДЕГИДЫ И КЕТОНЫ
АЛЬДЕГИДЫ И КЕТОНЫ _ _Производство цветных металлов. Методы плавки алюминия_
_ _Производство цветных металлов. Методы плавки алюминия_ Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии