Содержание
- 2. Мы здоровы и полны энергии. У нас все в жизни хорошо. Мы молоды, мы счастливы, мы
- 3. «Их получают путем горения Или сложных веществ разложения. В них два элемента, один – кислород. Я
- 4. «Они имеют кислый вкус. В них изменяет цвет лакмус. А если активный металл попадет, Получим мы
- 5. «В каких веществах у фенолфталеина Бывает не жизнь, а сплошная малина?» Щелочи NaOH, Ca(OH)2
- 6. NO HNO NaOH HNO 2 3 К какому классу соединений относятся вещества (дать им названия)
- 7. CO 2 2 H CO Mg(OH) 2 3 H SO 2 3 H SO 2 4
- 8. О каком веществе идёт речь? Войны за это вещество происходили в разные эпохи: за нее сражались
- 9. «Хлориды и нитраты, Сульфаты, карбонаты Я без труда и боли Объединю в класс...» Соли
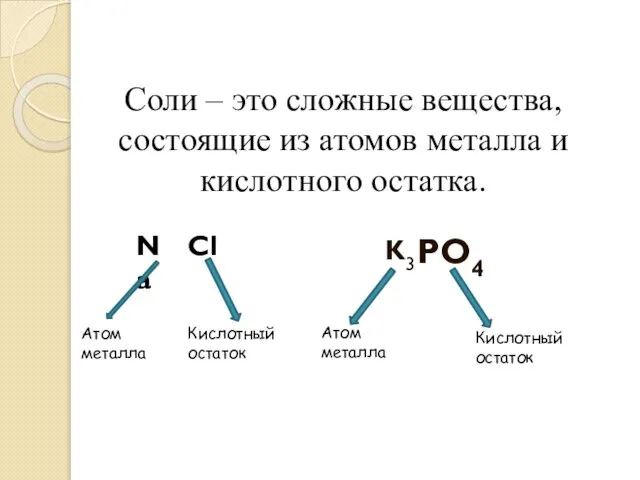
- 10. Соли – это сложные вещества, состоящие из атомов металла и кислотного остатка. PO4 K3
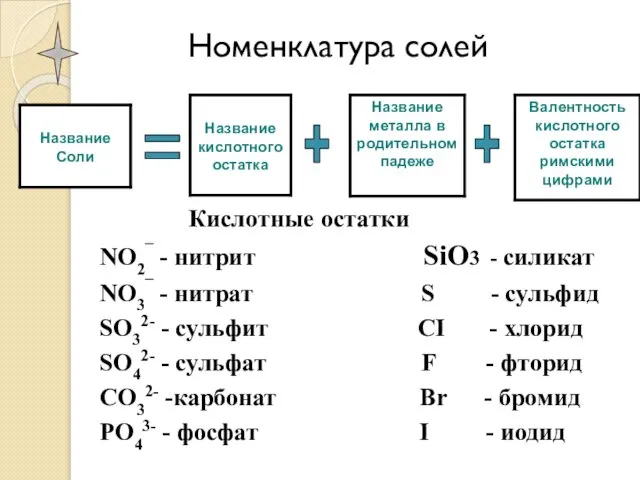
- 11. Номенклатура солей + + =
- 12. Помни каждый ученик, Знай любая кроха: Безопасность- хорошо, А халатность – плохо. Техника безопасности в кабинете
- 13. Техника безопасности в кабинете химии Категорически запрещается входить в кабинет химии без ...учителя В кабинете химии
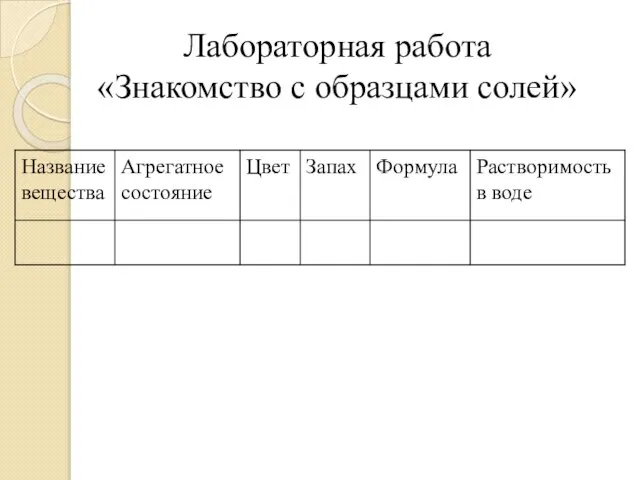
- 14. Лабораторная работа «Знакомство с образцами солей»
- 15. Физические свойства Соли – это твердые вещества разного цвета с различной растворимостью в воде
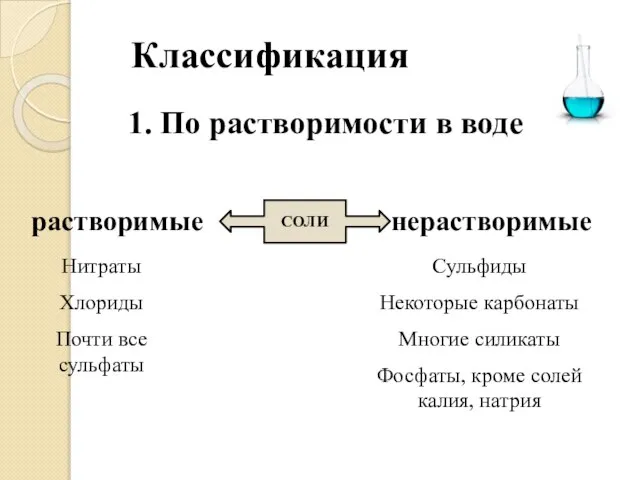
- 16. Классификация 1. По растворимости в воде СОЛИ растворимые нерастворимые Нитраты Хлориды Почти все сульфаты Сульфиды Некоторые
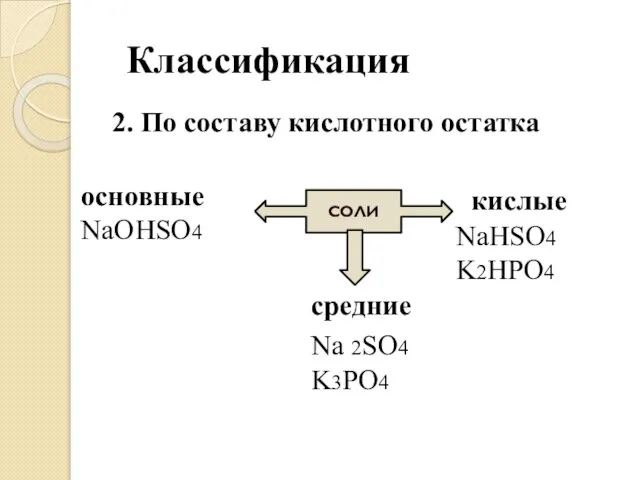
- 17. Классификация 2. По составу кислотного остатка
- 18. Тренажер для глаз Базарнова В. Ф.
- 19. Упражнения для улучшения мозгового кровообращения «Наклоны головы» Вперед – назад Вправо - влево
- 20. Упражнения для снятия утомления с плечевого пояса и рук «Рывки руками» «Сжимание кисти в кулак»
- 21. Упражнение для снятия напряжения с мышц туловища «Наклоны в сторону»
- 22. Задания: Назвать соли: KCl, LiNO3, BaSO4; Составьте формулы солей по названию: йодид натрия, сульфид цинка.
- 23. Критерии оценивая Оценка «5» - одна ошибка Оценка «4» - две ошибки Оценка «3» - три
- 24. Соляная зависимость самая древняя и самая сильная.Но люди не всегда испытывали такую зависимость от соли. Соли
- 25. Соли Гипс – кристаллогидрат сульфата кальция СаSO4 * 2H2O
- 26. Из мрамора (СаСО3) сделан дворец в Индии Тадж- Махал
- 27. Косметические соли
- 28. Лечение и профилактика заболеваний:
- 29. Рефлексия
- 30. Домашнее задание: Параграф 33 упр.3 стр. 112 Используя дополнительные источники информации, найдите примеры солей имеющих наибольшее
- 31. Спасибо за внимание!!!
- 33. Скачать презентацию
























 Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Практика по химии
Практика по химии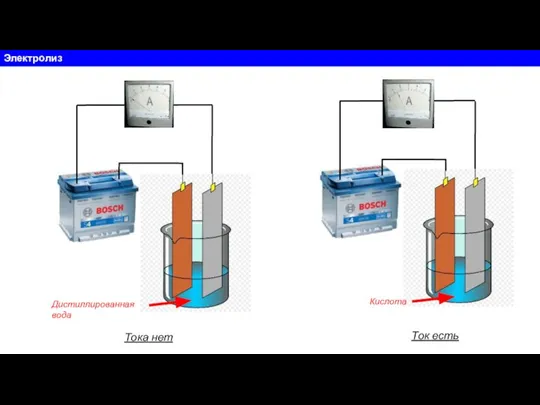 Электролиз. Электролитическая диссоциация
Электролиз. Электролитическая диссоциация Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Уравнения диссоциации
Уравнения диссоциации Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Валентность (7 класс)
Валентность (7 класс) Классификация органических реакций, реагентов
Классификация органических реакций, реагентов Незаменимая уксусная кислота
Незаменимая уксусная кислота Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Классы неорганических веществ
Классы неорганических веществ Критерии оценки качества природного газа
Критерии оценки качества природного газа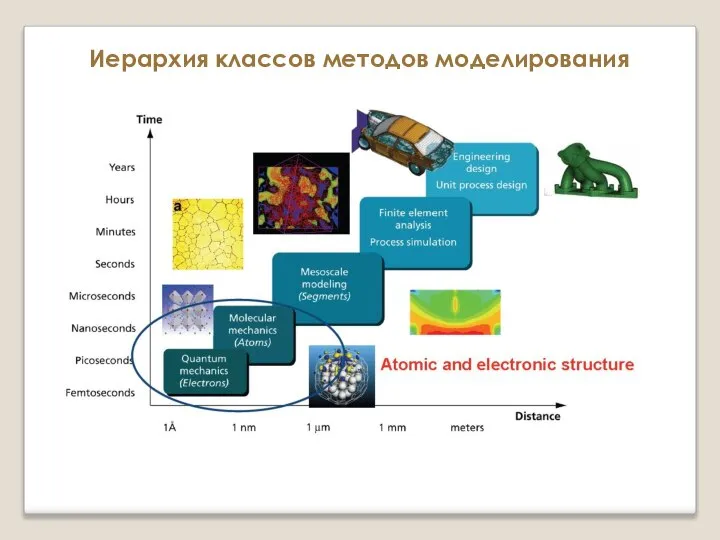 Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Распределение электронов в атомах
Распределение электронов в атомах Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Substanță chimică
Substanță chimică Методы разделения и очистки веществ
Методы разделения и очистки веществ Альдегиды
Альдегиды Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Свободные атомы. Простые вещества. Сложные вещества
Свободные атомы. Простые вещества. Сложные вещества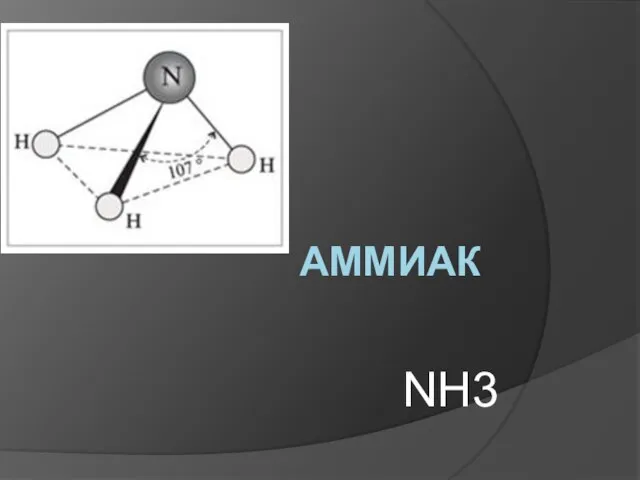 Аммиак NH3
Аммиак NH3 Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Удельная теплота сгорания
Удельная теплота сгорания