Слайд 2Нормальная концентрация (N)
N– определяет число грамм-эквивалентов (г-экв) растворенного вещества в 1 л

раствора.
Нормальная концентрация так же может быть выражена в мг-экв/л, мкг-экв/л.
Примеры. Приготовить 1 N HCI and 1 N H2SO4.
Решение. Для приготовления 1N HCI требуется 1 г-экв соляной кислоты, который определяется как (1+35,5)=36,5 г соляной кислоты.
Для приготовления 1 N H2SO4 необходимо взять 1 г-экв серной кислоты, который определяется как (2+32+64)/2=98/2 =49г серной кислоты.
Таким образом, для приготовления растворов в нормальной концентрации, необходимо учитывать эквивалент данного вещества (Э) и определять число эквивалентов этого вещества (n)
Слайд 3Определение эквивалентов различных веществ (Э)
Один грамм-эквивалент вещества численно равен его эквиваленту, выраженному

в граммах. Наиболее часто единица измерения эквивалента выражается следующим образом: Э=[Г/Г-ЭКВ], либо [мг/мг-экв].
Число эквивалентов (n, мг-экв), если вещество дается в массовых единицах (m), определяется по формуле : n=m/Э, [мг/мг/мг-экв]=[мг-экв].
Число эквивалентов (n), если вещество дается в виде концентрации (С, мг/л), определяется по формуле : n =С/Э [мг/л/мг/мг-экв]=[мг-экв/л].
Если известно число эквивалентов какого-либо вещества и найден его эквивалент, то концентрацию раствора определяют по формуле: С= n*Э, [мг-экв/л*мг/мг-экв]=[мг/л].
Расчет эквивалентов кислот производится следующим образом.
Э кислоты =М/а, здесь М - молекулярная масса кислоты,
а – число ионов Н+ в кислоте.
фосфорной ЭH3PO4= (3 + 31 + 64)/3= 98/3=32,66
азотной ЭHNO3=(1+14+48)/1=63/1=63
серной ЭH2SO4 =(2+32+64)/2 = 98/2=49
Слайд 4Определение эквивалентов различных веществ (Э)
Расчет эквивалентов оснований производится следующим образом.
Э основания

= М/b, здесь М - молекулярная масса основания,
b – число гидроксильных ионов (ОН-) в основании.
Э Mg(OH)2 =(24+17*2)/2=58/2=29
Э NaOH = (23+16+1)/1=40/1=40
Слайд 5Определение эквивалентов различных веществ (Э)
Расчет эквивалентов солей производится следующим образом.
Э соли =

М/n*m, где М – молекулярная масса соли,
n – число ионов металла в соли,
m – валентность металла. М(SO4)2- =32+16*4=96
Эквиваленты солей:
сернокислое железо ЭFe2(SO4)3 =(56*2+96*3)2*3=66,67.
хлористый кальций Э CaCI2 =(40+35,5*2)/2*1=55,5
xлористый натрий Э NaCI = (23+35,5)/1*1=58,5
сульф. алюм. ЭAI2(SO4)3 =(26*2+96*3)/3*2=(54+288)/3*2=342/3*2=57
Слайд 6Процентная концентрация (ПК)
ПК – показывает содержание растворенного вещества в 100 единицах массы

раствора, причем количество растворенного вещества и раствора берутся в одних и тех же весовых единицах.
Пример. Раствор гидроксида калия (КОН) 25 % концентрации содержит 25 г данного вещества и 75 г воды. Всего 100 г раствора.
Или 25 мг КОН в 100 мг раствора.
Весовая концентрация (ВК)
ВК- это количество растворенного вещества в единице объема раствора. Это может быть г/л, мг/л, кг/м3 , г/мл (титр раствора)
Слайд 7Решение типовых задач
Нахождение эквивалентов различных веществ
Задача №1. Сколько мг-экв содержится в 5,55

г CaCI2 ; 6,66 мг Fe2 (SO4 )3
348,36 мг K 2HPO 4 ; 0,286 мг Na2 CO3 *10 H2O
Решение : Находим эквиваленты соответствующих соединений.
Э CaCI2 =(40+35,5*2)/2*1=55,5
ЭFe2(SO4)3 =(56*2+96*3)2*3=66,67.
Э K 2HPO 4 = (39*2+1+31+16*4)/2=(78+1+31+64)/2= 87
ЭNa2CO3*10H2O =(23*2+12+16*3+10*18)/2=(46+12+48+180)/2=143
Определяем число эквивалентов соответствующих соединений (n) в мг-экв. nCaCI2=5550/55,5=100, n Fe2(SO4)3 =6,66/66,67=0,1
n K2HPO 4 =348,36/87=4, n Na2CO3*10H2O =0,286/143=0,002=2*10-3
Задание №1: найти эквиваленты различных соединений ( не менее 4). Соединения и их численные значения обучающийся задает самостоятельно.
Слайд 8Решение типовых задач
Определение правильности выполнения анализа природной воды.
Данный вид анализа

основывается на положении: сумма мг-экв/л катионов природной воды (nкатионов ) должна быть равна сумме мг-экв/л анионов
(nанионов ).
Задача №2. При анализе природной воды получены следующие результаты. концентрация катионов (мг/л): Na+ - 54,74 Ca2+ - 68,3 Mg2+ - 24,3 NH4+ - 12,3.
концентрация анионов (мг/л): SO42- - 180,3 CI- - 63,2 NO2- -3,8 NO3- - 14,7.
Щелочность (Щ) обусловлена, в основном, бикарбонатным ионом (НСО3- )
Щ=2,78 мг-экв/л. Щелочность относят к анионам. Жесткость общая– 5,38 мг-экв/л.
Проверить точность выполнения анализа и вычислить величину относительной ошибки измерения.







 Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Сера
Сера кремний и его соединения
кремний и его соединения Нефтяные дисперсные системы
Нефтяные дисперсные системы Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты  Substancje chemiczne
Substancje chemiczne Оксиды в мире минералов
Оксиды в мире минералов Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла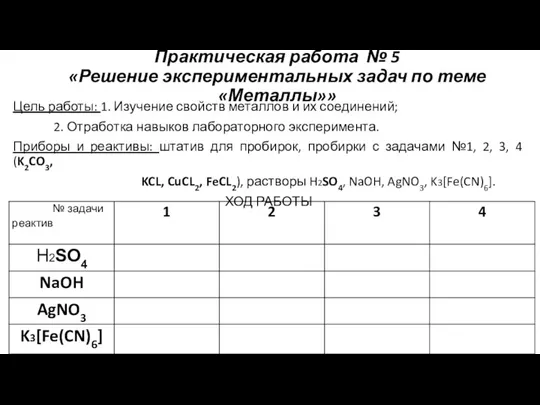 Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Химическое равновесие
Химическое равновесие Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи
Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Строение бензола
Строение бензола Свойства бензола
Свойства бензола Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Расчет энтропии образования и теплоемкости органических веществ методом Бенсона
Расчет энтропии образования и теплоемкости органических веществ методом Бенсона Типы химических реакций
Типы химических реакций Химия – это область чудес
Химия – это область чудес Химическая связь и строение молекул
Химическая связь и строение молекул Классы неорганических соединений
Классы неорганических соединений Презентация на тему Золото
Презентация на тему Золото  Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Движение электрона в атоме
Движение электрона в атоме Неметаллы и их соединения
Неметаллы и их соединения Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Понятие об ароматических спиртах и фенолах. Особенности строения фенола
Понятие об ароматических спиртах и фенолах. Особенности строения фенола Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Фосфор
Фосфор