Содержание
- 2. Атом – Химический элемент – Доказательства сложности строения атома: Открытие рентгеновских лучей Открытие радиоактивности Открытие «катодных
- 3. Модели строения атома Пудинг с изюмом (1902-04 гг) Кельвин, Томсон) Планетарная (1907-13 гг) Резерфорда-Бора Модель Бора-Зоммерфельда
- 5. Модель Резерфорда
- 6. Схема строения атома
- 8. Современные представления о делимости нуклонов
- 9. Основные характеристики протонов, нейтронов и электронов
- 10. Обратите внимание! При решении задач ЕГЭ среднее значение относительной атомной массы всех атомов, кроме хлора, округляется
- 11. Порядковый номер химического элемента в Периодической таблице – Массовое число – Номер периода – Номер группы
- 12. Изменение числа протонов- появление нового элемента. Изменение числа нейтронов – появление изотопов одного и того же
- 13. Изотопы водорода
- 14. Попробуйте ответить на вопросы: 1. У изотопов одного элемента массовое число одинаковое или разное? 2. У
- 15. 3. Определите количество нейтронов, протонов и электронов в изотопе брома-81. 4. Определите число нейтронов в изотопе
- 16. Электронное облако – Электронная орбиталь – Формы электронных орбиталей -
- 17. Варианты расположения орбиталей в пространстве
- 20. Сводная таблица
- 23. Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного
- 24. Энергетическая диаграмма атома углерода Электронная формула С +6 1s22s22p2
- 25. Электронные формулы элементов первых четырех периодов H +1 1s1 1s He +2 1s2 1s Li +3
- 26. Ne +10 1s22s22p6 1s 2s 2p Na+11 1s22s22p63s1 1s 2s 2p 3s У неона завершено заполнение
- 27. А вот начиная с 19-го элемента, калия, заполняется не 3d-орбиталь, а 4s. Заполнение энергетических уровней и
- 28. У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня: Sc +21 1s22s22p63s23p63d14s2 3d 4s
- 29. Основное и возбужденное состояние атома бора B +5 1s22s22p1 1s 2s 2p B* +5 1s22s12p2 1s
- 30. Электронные формулы ионов Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что
- 32. Скачать презентацию





























 h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Комплексные соединения
Комплексные соединения Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Понятие о полимере. Технологии обработки пластмасс
Понятие о полимере. Технологии обработки пластмасс Триметилалюминий
Триметилалюминий Синтетические и натуральные краски
Синтетические и натуральные краски Алюминий. 9 класс
Алюминий. 9 класс Окислительновосстановительные реакции. 9 класс
Окислительновосстановительные реакции. 9 класс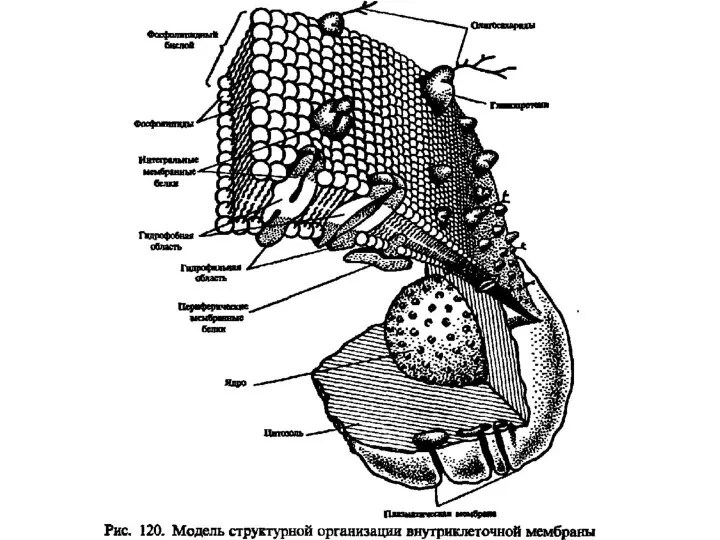 Липиды. Классификация липидов
Липиды. Классификация липидов Фенол. Понятие о фенолах
Фенол. Понятие о фенолах Азотная кислота
Азотная кислота Лекция_классы_неогранических_соединений
Лекция_классы_неогранических_соединений Органическая химия. Получение альдегидов и кетонов
Органическая химия. Получение альдегидов и кетонов Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Цезий
Цезий Гималайская соль
Гималайская соль Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Углеводы, 2 часть. Лекция 15
Углеводы, 2 часть. Лекция 15 Электролиты. Химический диктант (9 класс)
Электролиты. Химический диктант (9 класс)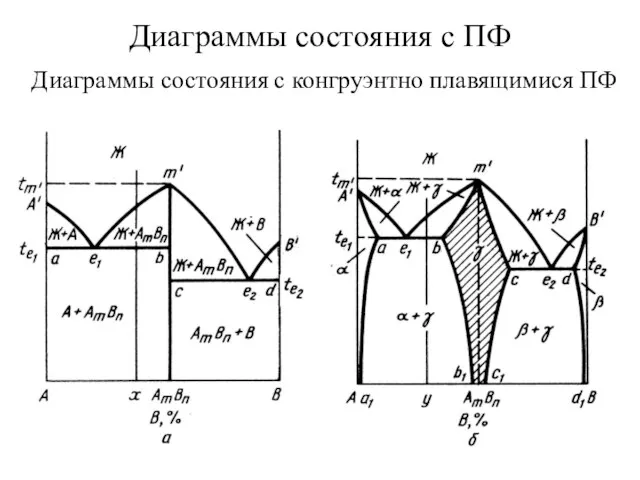 Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ
Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ Аммиак. Азот
Аммиак. Азот Закалка без полиморфного превращения
Закалка без полиморфного превращения Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Кремний
Кремний Отрасли химии
Отрасли химии Предельные углеводороды. Тест 19
Предельные углеводороды. Тест 19 Установочная лекция по специальной химии для студентов специальности Прикладная геология
Установочная лекция по специальной химии для студентов специальности Прикладная геология Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды