Содержание
- 3. Все вещества по отношению к элект- рическому току можно разделить на : их растворы или расплавы
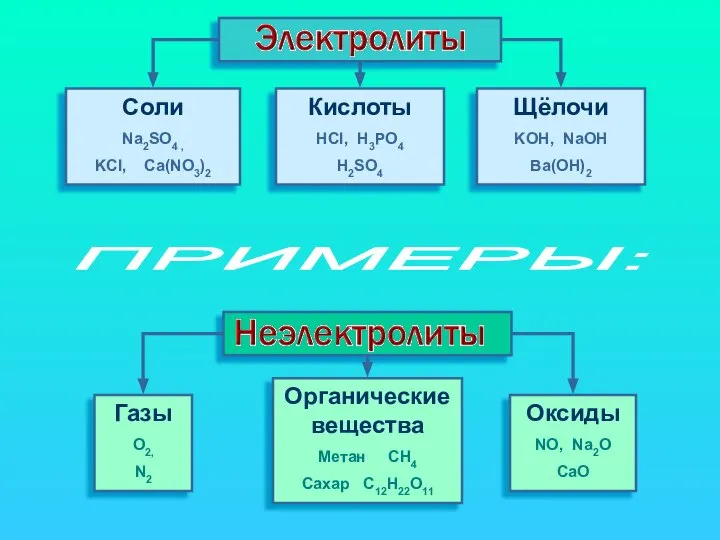
- 4. Cоли Na2SO4 , KCl, Ca(NO3)2 Кислоты HCl, H3PO4 H2SO4 Щёлочи KOH, NaOH Ba(OH)2 Газы O2, N2
- 5. Процесс появления гидратированных ионов в водном растворе называется электролитической диссоциацией (С. Аррениус, 1887 г.) .
- 7. Все вещества по их способности проводить электрический ток в растворах или расплавах делятся на электролиты и
- 8. В растворах электролиты диссоциируют ( распадаются) на положительные и отрицательные ионы. Процесс распада электролита на ионы
- 9. Причиной диссоциации электролита является его взаимодействие с молекулами воды, т.е. его гидратация
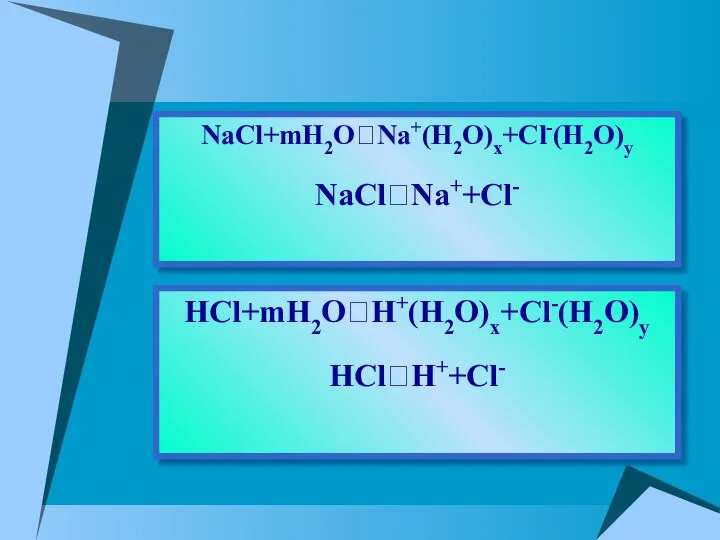
- 10. HCl+mH2O⮀H+(H2O)x+Cl-(H2O)y HCl⮀H++Cl- NaCl+mH2O⮀Na+(H2O)x+Cl-(H2O)y NaCl⮀Na++Cl-
- 11. Под действием тока положительные ионы движутся к катоду и называются катионы, а отрицательные – к аноду
- 12. Не все электролиты в одинаковой мере диссоциируют на ионы КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
- 13. - степень электролитической диссоциации n – число молекул, которые распались на ионы в растворе N –
- 14. Сильные электролиты α > 30% Средние водорастворимые соли NaCl, K2SO4, Ba(NO3)2 и т д; Гидроксиды щелочных
- 15. Электролиты средней силы 3% ≤ α ≤ 30% H3PO3, H3PO4, H4P2O7, H2SO3, HF, HClO2, Fe(OH)2,
- 16. Слабые электролиты α Органические кислоты: HCOOH, CH3COOH, C2H5COOH Минеральные кислоты: HNO2, HClO, H2CO3, H2SiO3, H3BO3, H3PO3,
- 17. Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 18. Классы неоргани-ческих веществ с точки зрения ТЭД
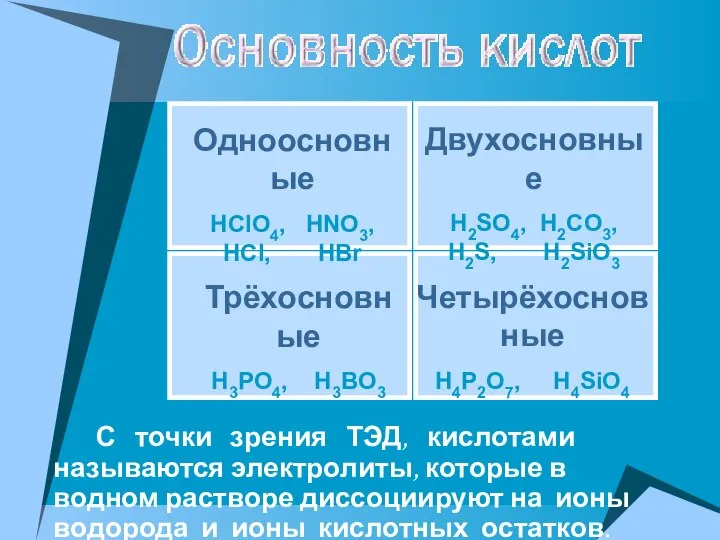
- 19. С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и
- 20. HCl = H+ + Cl- HNO3 = H+ + NO3- HClO4 = H+ + ClO4- Кислоты
- 21. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. Сильный электролит H2SO4⮀H++ HSO4-α1 HSO4 -
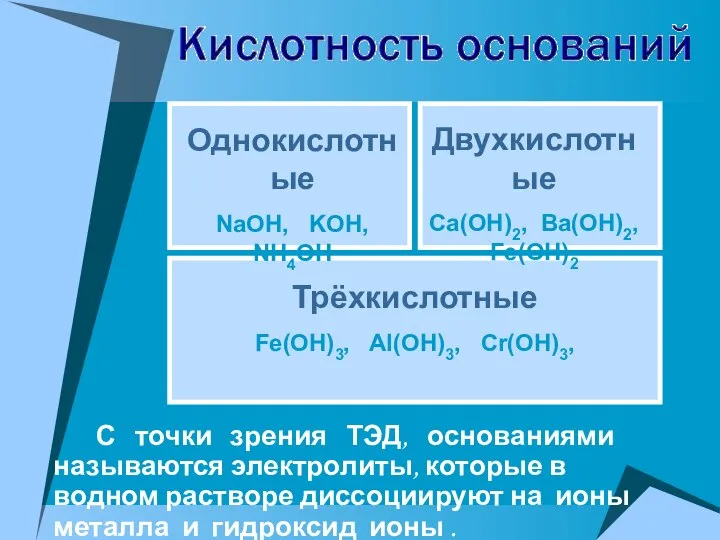
- 22. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 23. NaOH = Na+ + OH- Ba(OH)2 = BaOH+ + OH- → Ba2+ + 2OH- KOH =
- 24. Соли – это электролиты, которые диссоциируют на катионы металла или аммония NH4+ и анионы кислотных остатков.
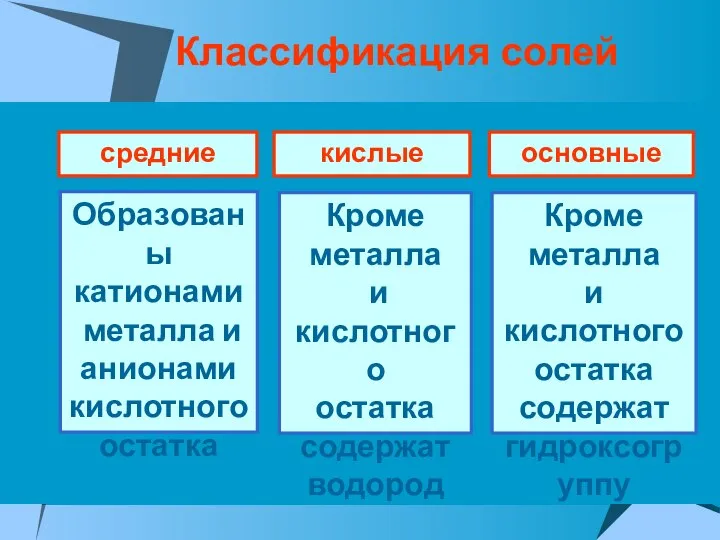
- 25. Классификация солей средние кислые основные Образованы катионами металла и анионами кислотного остатка Кроме металла и кислотного
- 26. Na2SO4 = 2Na+ + SO42- AlCl3 = Al3+ + 3Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42- С
- 27. С точки зрения ТЭД, кислыми солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 28. С точки зрения ТЭД, основными солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
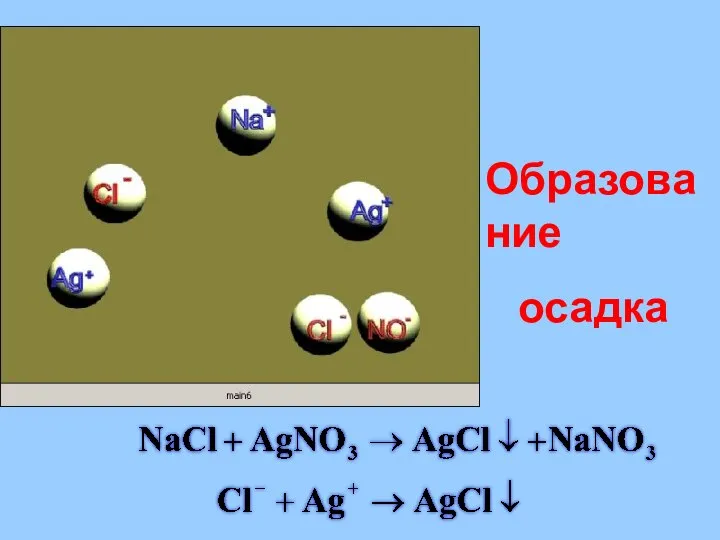
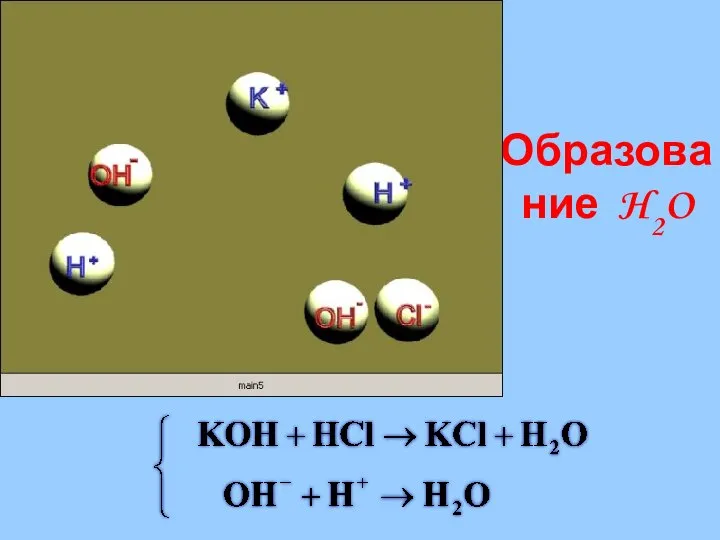
- 29. Реакции в растворах электролитов протекают до конца если: Образуется или растворяется осадок; Выделяется газ; Образуется малодиссоциирующее
- 30. Образование осадка
- 31. Образование H2O
- 33. Скачать презентацию























 Ионные уравнения
Ионные уравнения Минералы и горные породы
Минералы и горные породы Производство концентрированной азотной кислоты (лекция 15)
Производство концентрированной азотной кислоты (лекция 15) Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Урок по химии в 10 классе на тему: «Жиры» 2008 год.
Урок по химии в 10 классе на тему: «Жиры» 2008 год. Презентация на тему Теория строения органических соединений А.М. Бутлерова
Презентация на тему Теория строения органических соединений А.М. Бутлерова  Спирты и их производные
Спирты и их производные Алкины
Алкины Образовательный конкурс Химия - это?! II тур Химия – это практично
Образовательный конкурс Химия - это?! II тур Химия – это практично Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Спирты
Спирты Путешествие в страну Нефтехимия
Путешествие в страну Нефтехимия Химия и сельское хозяйство
Химия и сельское хозяйство Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum
Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum Алкадиены. Каучук
Алкадиены. Каучук Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Анилин
Анилин Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Статистика в аналитической химии
Статистика в аналитической химии Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Синтетическое моторное масло. Маркировка моторных масел
Синтетическое моторное масло. Маркировка моторных масел Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Планарные потенциометрические сенсоры на основе пилларарена -DNS-162
Планарные потенциометрические сенсоры на основе пилларарена -DNS-162