Содержание
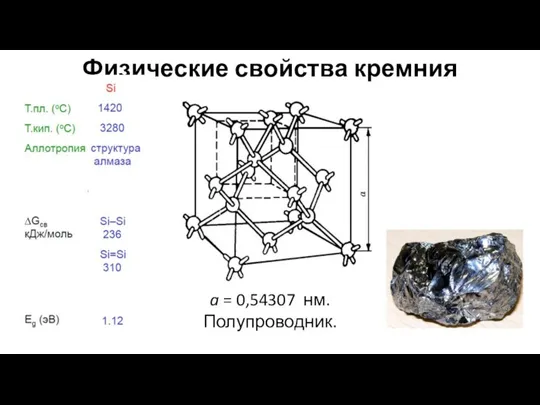
- 2. Физические свойства кремния a = 0,54307 нм. Полупроводник.
- 3. Нахождение в природе, получение Кремний – второй по распространенности (после кислорода) элемент в земной коре (25,7
- 4. Химические свойства кремния Химически более активен по сравнению с углеродом в форме алмаза. Электроотрицательность атома кремния
- 5. 3. Кремний стоек в кислотах. Единственная кислотная смесь, в которой растворяется кремний, HNO3конц + HFконц: 3
- 6. Силициды ∙Силициды известны для всех элементов 1 − 10 групп, кроме бериллия. В 11, 12 группах
- 7. Химическая связь в силицидах щелочных и щелочно-земельных металлов может быть рассмотрена как ионная. Они более реакционноспособны:
- 8. Кремневодороды (силаны, гидриды кремния) Известны силаны SinH2n+2 с разветвленными и неразветвленными цепями до n = 8
- 9. Получение силанов Обработка силицидов, содержащих Siδ−, протонным реагентом, например, водным раствором кислоты. С 1945 г. метод
- 10. Химические свойства силанов Сильные восстановители (сильнее углеводородов). Вспыхивают на воздухе: SiH4 + 2 O2 → SiO2
- 11. Оксид кремния(IV) Существует в виде полиморфных модификаций: Отличаются способом сочленения тетраэдров [SiO4].
- 12. Свойства диоксида кремния Строго говоря, свойства зависят от модификации, но, в целом, SiO2 – достаточно инертное
- 13. Кремниевые кислоты SiO2⋅nH2O H4SiO4 − единственная мономерная форма кремниевых кислот. Устойчива только в очень разбавленных растворах
- 14. Силикаты. Силикагель В воде растворимы только силикаты щелочных металлов. В растворе силикаты сильно гидролизованы. Формально процесс
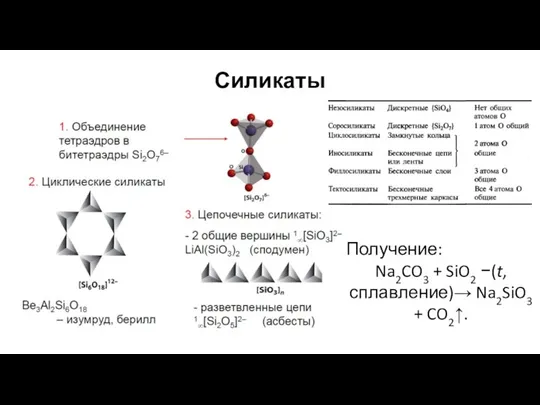
- 15. Силикаты Получение: Na2CO3 + SiO2 −(t, сплавление)→ Na2SiO3 + CO2↑.
- 16. Цеолиты Алюмосиликатные материалы. Структура цеолитов представлена тетраэдрами SiO44− и AlO45−, объединенными в полиэдры так, что образуется
- 17. Галогениды кремния Получение SiO2 + 4 HFг −(250−400 °С)→ SiF4 + 2 H2O SiO2 + 2
- 18. Сульфид кремния Кремний горит в парах серы: Si + 2 Sг −(t)→ SiS2 Не демонстрирует такое
- 19. Нитрид кремния Кристаллическое вещество белого цвета (tпл = 1930 °С), характеризующееся чрезвычайной химической инертностью. Получение: 3
- 20. Применение кремния и его соединений Стекло − аморфный материал (переохлажденная жидкость). Можно получить очень быстрым охлаждением
- 21. Германий, олово, свинец. Нахождение в природе, получение Германия в земной коре достаточно много (2,1⋅10−4 масс.%), но
- 22. Относительно большое содержание свинца в земной коре (1,3⋅10−4 масс. %), что связано с тем, что его
- 23. Строение и физические свойства Ge, Sn, Pb В ряду Ge − Sn − Pb происходит нарастание
- 24. Химические свойства Ge, Sn, Pb В ряду Ge − Sn − Pb происходит нарастание металлических свойств.
- 25. Олово медленно растворяется в кислотах-неокислителях (E°(Sn2+/Sn) = −0,14 В (с.в.э.), движущая сила процесса невелика, образуется Sn+2):
- 26. Более сильные, чем H+1, окислители переводят олово в степень окисления +4: Sn + 4 H2SO4конц −(t)→
- 27. У Pb(II) мало растворимых солей (только нитрат, ацетат, фторборат). По этой причине свинец практически не растворяется
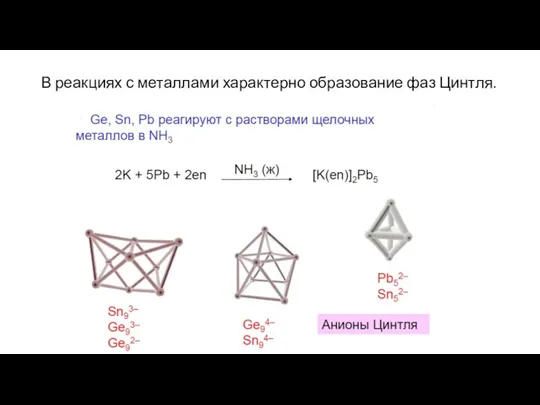
- 28. В реакциях с металлами характерно образование фаз Цинтля.
- 29. Гидриды элементов подгруппы германия Германий, подобно кремнию, образует германоводороды. Гомологический ряд GenH2n+2 существует до n =
- 30. Оксиды германия, олова, свинца Соединения в степени окисления +4 По мере движения по группе координационные числа
- 31. GeO2 существует в виде нескольких модификаций: Гексагональный β-GeO2 имеет такую же структуру как α-кварц, германий имеет
- 32. SnO2 − оловянный камень. Малореакционноспособное соединение. Пути перевода в растворимое состояние: SnO2 + Na2CO3 −(t, сплавление)→
- 33. PbO2, в отличие от SnO2 и GeO2, является сильным окислителем. Получение: Pb(CH3COO)2 + CaOCl2 + H2O
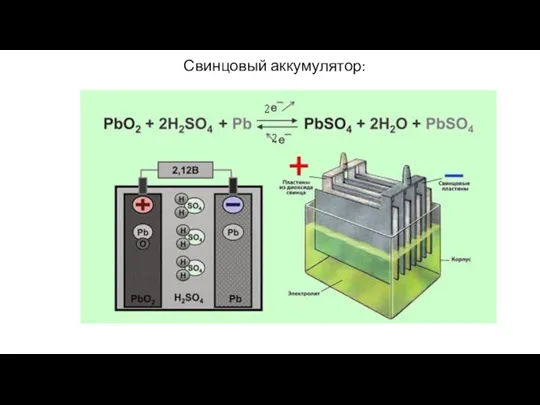
- 34. Свинцовый аккумулятор:
- 35. Оксиды элементов в степени окисления +2 GeO неустойчив и диспропорционирует: 2 GeO ⇄ Ge + GeO2
- 36. Смешанные оксиды свинца Pb2O3 (Pb+2O⋅Pb+4O2) – черный Pb3O4 (2 Pb+2O⋅Pb+4O2) − свинцовый сурик, красный. 3 Pb
- 37. Соли Sn(II) Сильно гидролизованы, образуется мутный раствор из-за образования основных солей: SnCl2 + H2O ⇄ (SnOH)Cl
- 38. Соли свинца (II) Малорастворимы, из простых солей растворимы только нитрат, перхлорат и ацетат. Pb(CH3COO)2⋅3 H2O −
- 39. Сульфиды элементов подгруппы германия Степень окисления +4 Pb+4S2 не существует. Получение: 1) из простых веществ; 2)
- 40. Сульфиды +2 Получение – осаждение из кислых растворов: SnCl2 + H2S → SnS↓ + 2 HCl
- 42. Скачать презентацию








![Оксид кремния(IV) Существует в виде полиморфных модификаций: Отличаются способом сочленения тетраэдров [SiO4].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1056893/slide-10.jpg)


























 α-карбин и β-карбин
α-карбин и β-карбин Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Количество вещества. Решение задач
Количество вещества. Решение задач Графит (С)
Графит (С) Литий
Литий Очистка поваренной соли методом кристаллизации в домашних условиях
Очистка поваренной соли методом кристаллизации в домашних условиях Медь и её сплавы
Медь и её сплавы относительная атомная масса
относительная атомная масса Сельскохозяйственная токсикология
Сельскохозяйственная токсикология Олигосахариды и полисахариды
Олигосахариды и полисахариды Магний(Mg)
Магний(Mg) Классификация_органических_соединений[1]
Классификация_органических_соединений[1] Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Смеси: гетерогенные, гомогенные
Смеси: гетерогенные, гомогенные Классификация, номенклатуры, изомерия
Классификация, номенклатуры, изомерия Простые вещества – неметаллы
Простые вещества – неметаллы Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии
Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии Антидетонационные добавки на основе синергетических смесей оксигенатов к бензиновым топливам
Антидетонационные добавки на основе синергетических смесей оксигенатов к бензиновым топливам Растворы полимеров
Растворы полимеров Уравнения химических реакций
Уравнения химических реакций Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи
Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи Классификация химических реакций
Классификация химических реакций Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева
Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Скорость химических реакций
Скорость химических реакций Тепловые, массобменные и химические процессы
Тепловые, массобменные и химические процессы MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2