Содержание
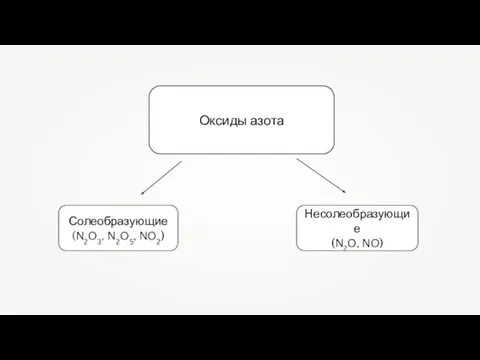
- 2. Оксиды азота
- 3. 2NO + О2 = 2NO2
- 4. АЗОТНАЯ КИСЛОТА
- 5. N2O3 + Н2О = 2HNO2 N2O5 + Н2О = 2HNO3 2NO2 + Н2О = HNO3 +
- 6. 4HNO3 = 2Н2О + О2↑ + 4NO2↑
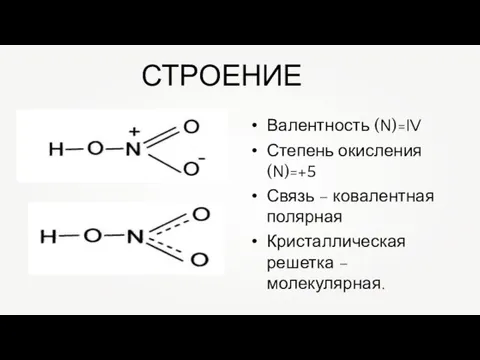
- 7. СТРОЕНИЕ Валентность (N)=IV Степень окисления (N)=+5 Связь – ковалентная полярная Кристаллическая решетка – молекулярная.
- 8. ХАРАКТЕРИСТИКА HNO3 Одноосновная Кислородсодержащая Нестабильная Летучая Сильный электролит Сильный окислитель 4HNO3→ 4NO2 + 2H2O + O2
- 9. Физические свойства Безводная HNO3 при обычной температуре – бесцветная летучая жидкость со специфическим запахом, tкип.=82,6°С, концентрированная
- 10. I. Общие с другими кислотами: 1) Действие на индикаторы HNO3 ⮀ H++NO3- Синий лакмус ⭢ красный
- 11. 2HNO3 + СаО = Са(NO3)2 + Н2О 2) Взаимодействует с основными оксидами: 3) Взаимодействует с амфотерными
- 12. II. Окислительные свойства. 1) Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий
- 13. При взаимодействии азотной кислоты с металлами не выделяется водород. Продукт реакции зависит от нескольких факторов: положения
- 15. 2) Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень
- 16. Вывод: HNO3 – очень реакционно-способное вещество. В химических реакциях проявляет себя как сильная кислота и как
- 18. Применение азотной кислоты: – производство минеральных азотных удобрений; – производство искусственных волокон; – производство пластических масс;
- 19. Нитраты — соли азотной кислоты. Соли азотной кислоты, такие как нитрат натрия NaNO3, нитрат калия KNO3,
- 20. KNO3 используют при изготовлении чёрного пороха. NH4NO3 применяют в изготовлении аммонала. AgNO3 используют в медицине в
- 22. Скачать презентацию
















 Металлы и их соединения
Металлы и их соединения Химия углеводов
Химия углеводов Своя игра. Атомы
Своя игра. Атомы Нефть и её переработка
Нефть и её переработка Полимеры и пластмассы
Полимеры и пластмассы lektsia_7
lektsia_7 Силумины. Виды силуминов
Силумины. Виды силуминов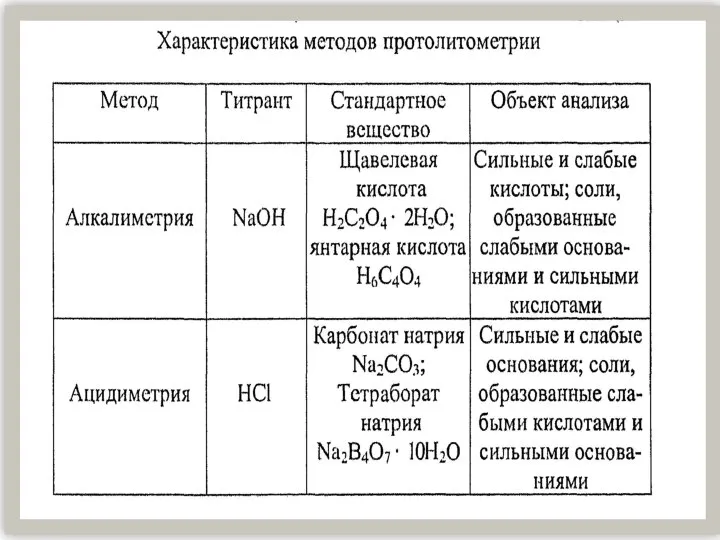 Характеристика методов протолитометрии
Характеристика методов протолитометрии alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1
alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1 Разложение отходов. 11 класс
Разложение отходов. 11 класс Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка
Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка Движение электрона в атоме
Движение электрона в атоме Оксосоединения. Альдегиды и кетоны
Оксосоединения. Альдегиды и кетоны Переваривание и всасывание жиров
Переваривание и всасывание жиров Химическое равновесие
Химическое равновесие Теория радиационной деформации в некубических металлах: явление анизотропной диффузии
Теория радиационной деформации в некубических металлах: явление анизотропной диффузии Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура 10_KISLOTNO_OSNOVNOE_TITROVANIE
10_KISLOTNO_OSNOVNOE_TITROVANIE Углеводороды
Углеводороды Буферные системы
Буферные системы Получение галогеноалканов
Получение галогеноалканов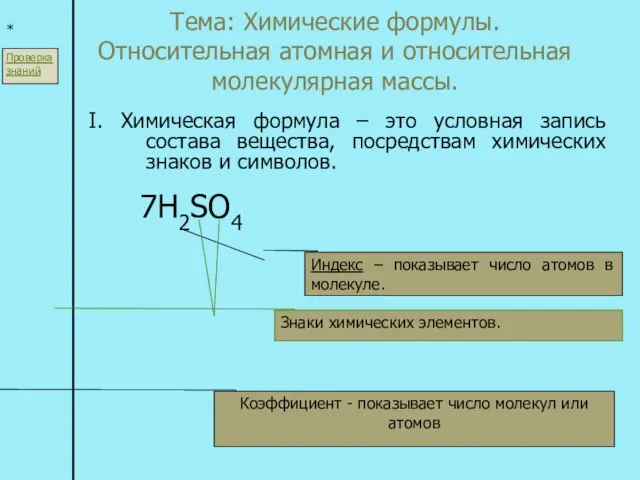 Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с
Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с Презентация на тему День Земли, Воды и Чистого воздуха
Презентация на тему День Земли, Воды и Чистого воздуха  Молярный объем
Молярный объем Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Арены. Бензол
Арены. Бензол Органическая химия. Введение
Органическая химия. Введение Ацетиленди гидратациялау
Ацетиленди гидратациялау