Содержание
- 2. В природе вещества встречаются в 3-х состояниях: Твёрдом; Жидком; Газообразном
- 3. Твёрдое тело имеет собственную форму и объём. Жидкости легко меняют свою форму, но сохраняют объём. Вещество
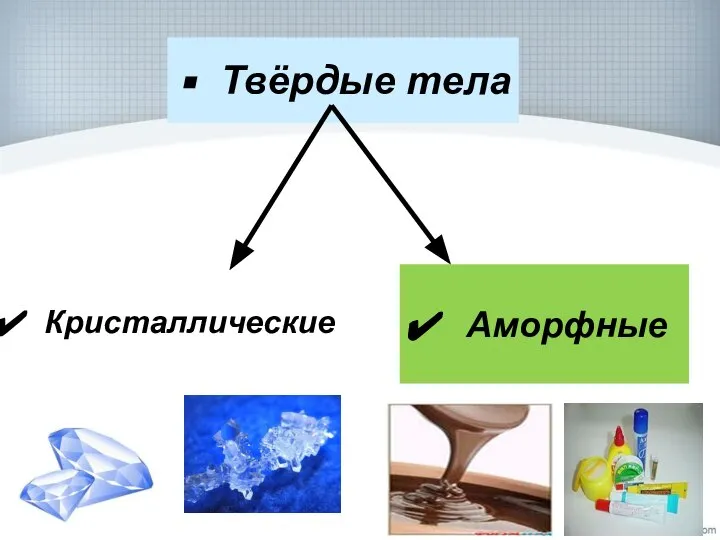
- 4. Твёрдые тела Аморфные Кристаллические
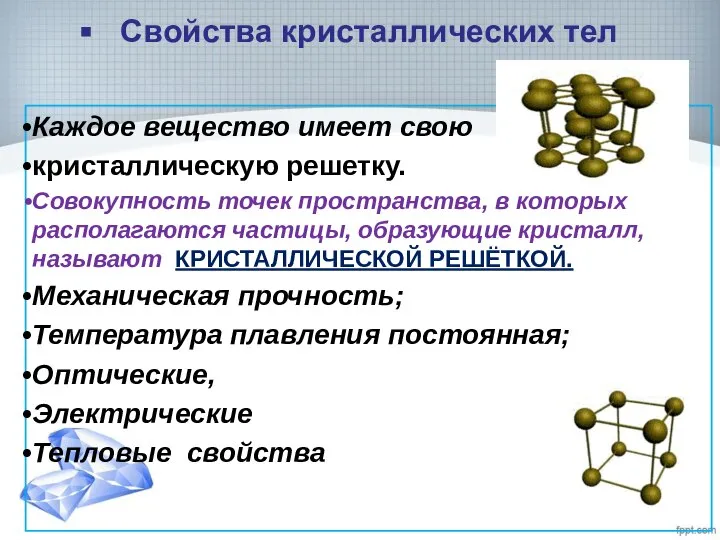
- 5. Свойства кристаллических тел Каждое вещество имеет свою кристаллическую решетку. Совокупность точек пространства, в которых располагаются частицы,
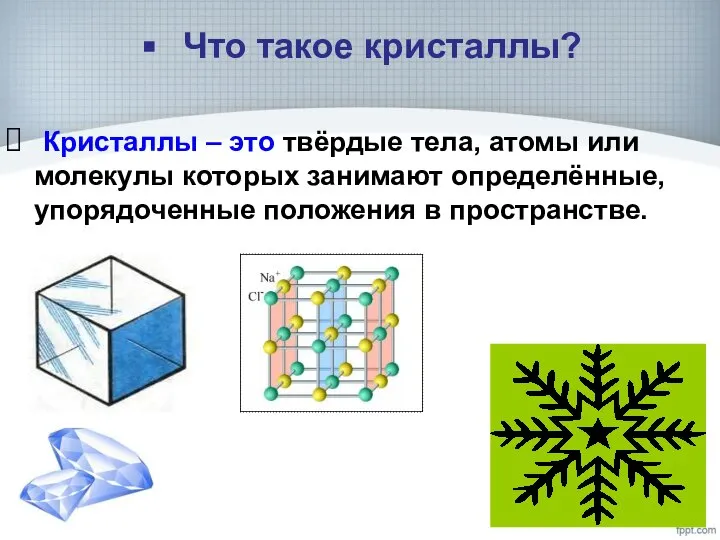
- 6. Что такое кристаллы? Кристаллы – это твёрдые тела, атомы или молекулы которых занимают определённые, упорядоченные положения
- 7. Кристаллические тела Кристаллические тела- это тела определённой геометрической формы, ограниченные естественными плоскими гранями
- 8. Кристаллические тела
- 9. Кристаллические решетки Криста́ллы (от греч. κρύσταλλος, — лёд, горный хрусталь, кристалл) — твёрдые тела, в которых
- 10. Кристаллические решетки Кристаллы – твердые вещества, частицы которых образуют периодически повторяющуюся в пространстве структуру – кристаллическую
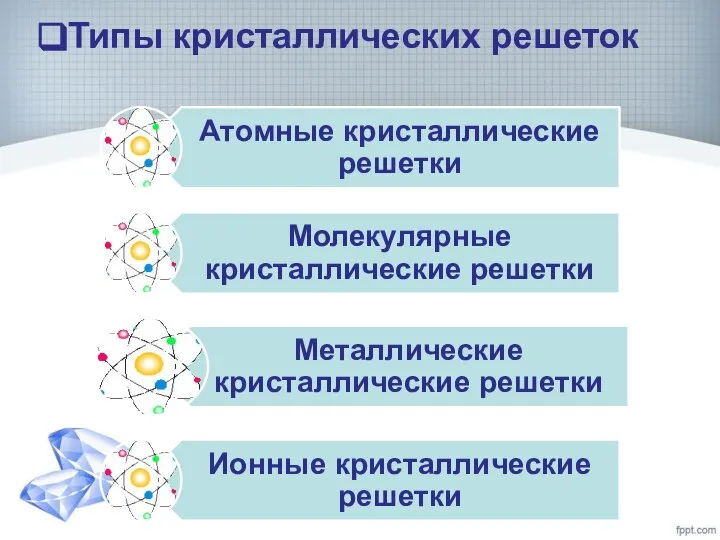
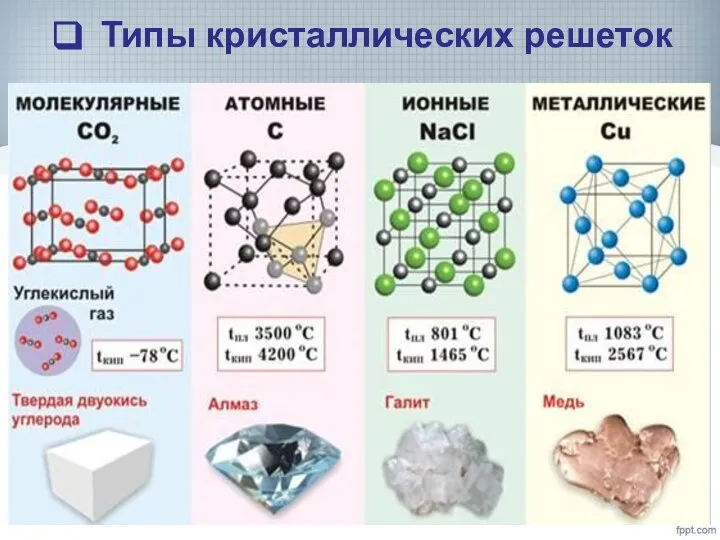
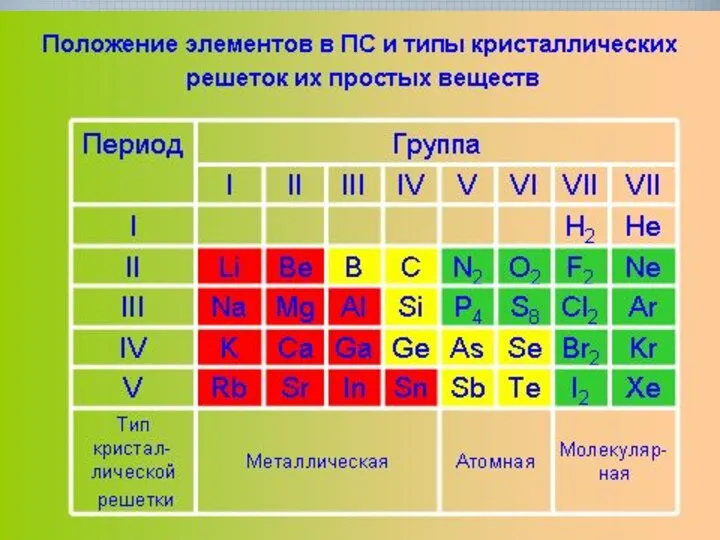
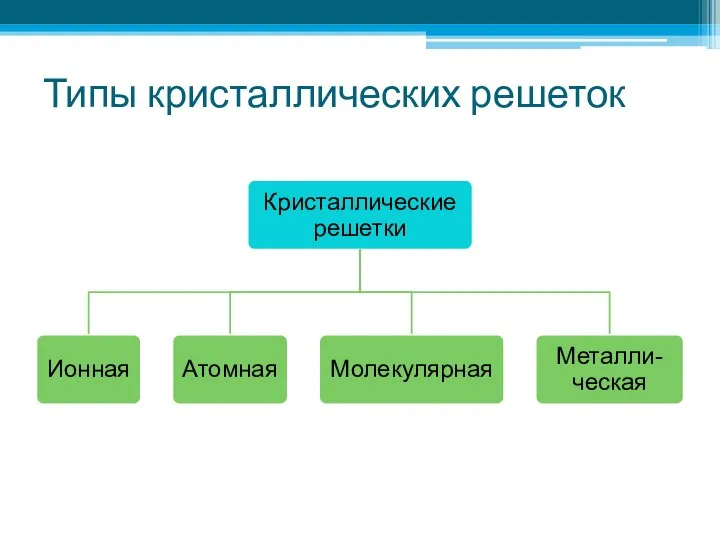
- 11. Типы кристаллических решеток
- 12. Типы кристаллических решеток
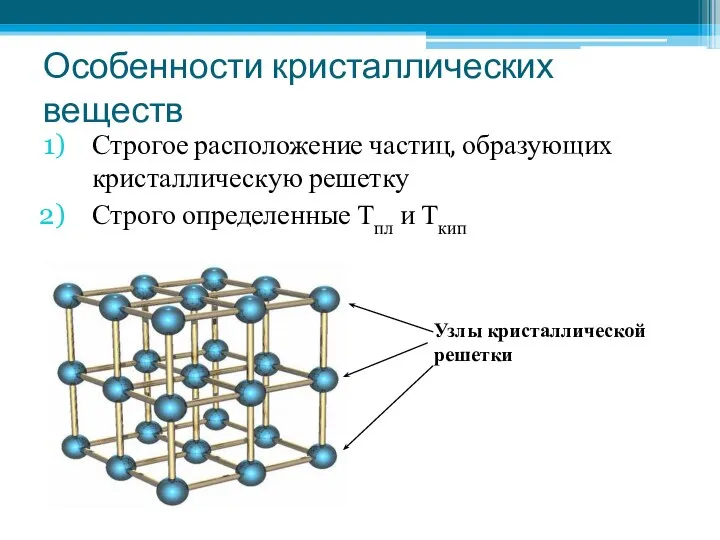
- 14. Особенности кристаллических веществ Строгое расположение частиц, образующих кристаллическую решетку Строго определенные Тпл и Ткип Узлы кристаллической
- 15. Типы кристаллических решеток
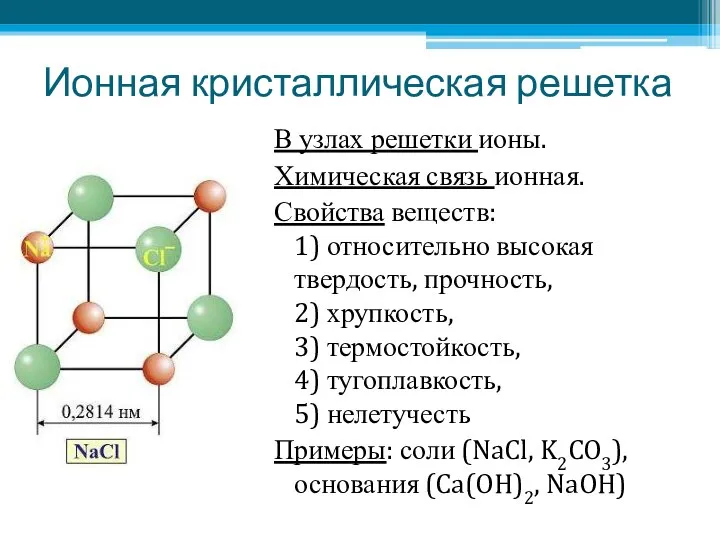
- 16. Ионная кристаллическая решетка В узлах решетки ионы. Химическая связь ионная. Свойства веществ: 1) относительно высокая твердость,
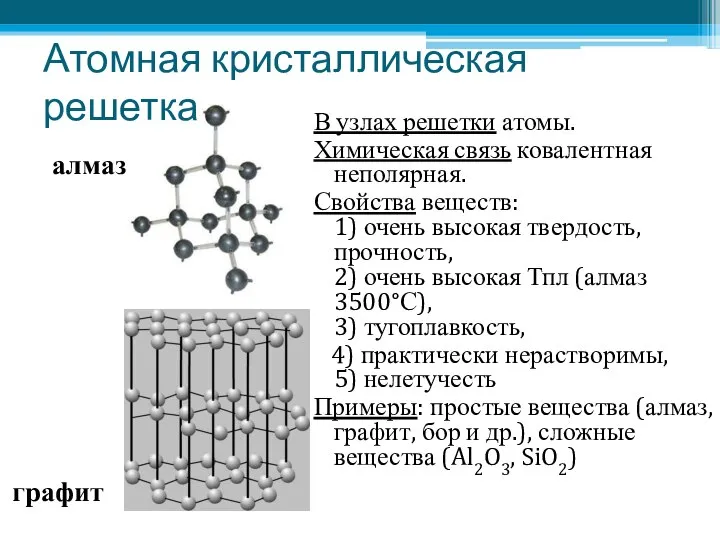
- 17. Атомная кристаллическая решетка В узлах решетки атомы. Химическая связь ковалентная неполярная. Свойства веществ: 1) очень высокая
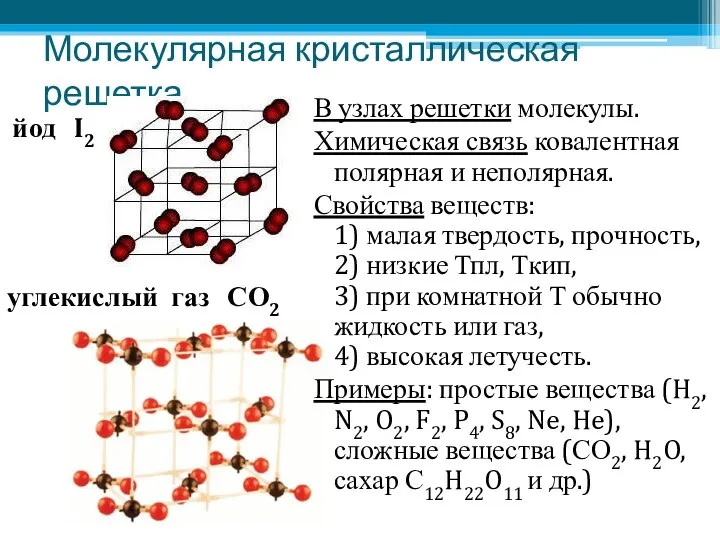
- 18. Молекулярная кристаллическая решетка В узлах решетки молекулы. Химическая связь ковалентная полярная и неполярная. Свойства веществ: 1)
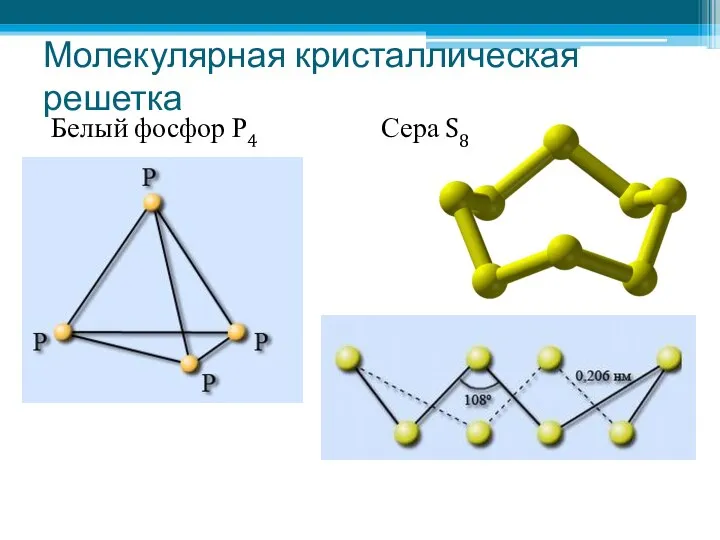
- 19. Молекулярная кристаллическая решетка Белый фосфор Р4 Сера S8
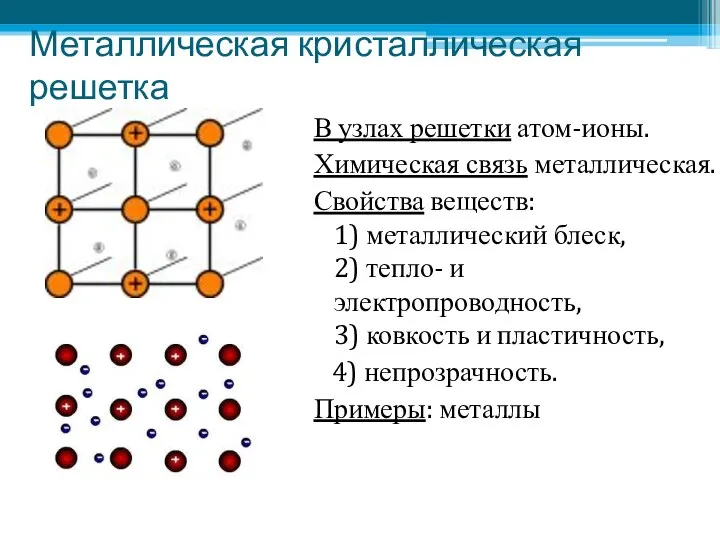
- 20. Металлическая кристаллическая решетка В узлах решетки атом-ионы. Химическая связь металлическая. Свойства веществ: 1) металлический блеск, 2)
- 21. Закон постоянства состава (Пруст, 1799-1803) Молекулярные химические соединения независимо от способа их получения имеют постоянный состав
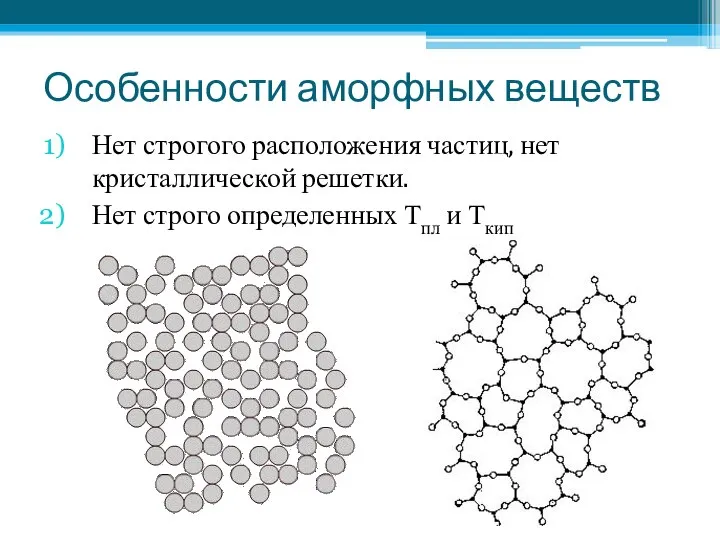
- 22. Особенности аморфных веществ Нет строгого расположения частиц, нет кристаллической решетки. Нет строго определенных Тпл и Ткип
- 23. Аморфные вещества
- 24. Аморфные вещества
- 25. Аморфные вещества
- 26. Аморфные вещества
- 27. Аморфные вещества
- 28. Аморфные вещества
- 29. Аморфные вещества
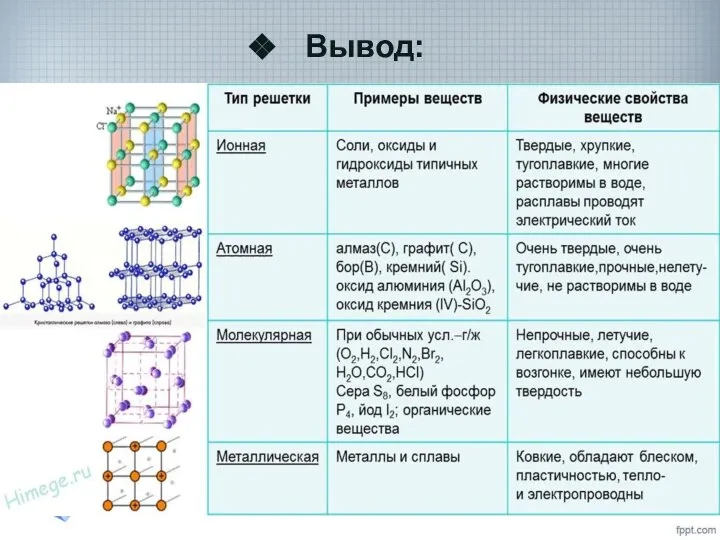
- 30. Вывод: Вещества молекулярного и немолекулярного строения отличаются по своим свойствам. Физические свойства веществ зависят от строения
- 32. Скачать презентацию














 Дисперсные системы. Тест
Дисперсные системы. Тест Неметаллы
Неметаллы Лабораторно-практическое занятие № 5. Неметаллические материалы
Лабораторно-практическое занятие № 5. Неметаллические материалы Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Общие свойства неметаллов
Общие свойства неметаллов Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Химическая связь
Химическая связь Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Гидролиз солей
Гидролиз солей Кислотные оксиды
Кислотные оксиды Простые вещества – неметаллы
Простые вещества – неметаллы Алканы. Зачетная работа
Алканы. Зачетная работа Нефтяные дисперсные системы
Нефтяные дисперсные системы Презентация на тему ОВР в органической химии 11 класс
Презентация на тему ОВР в органической химии 11 класс  Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей. 8 класс
Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей. 8 класс Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Водород
Водород Презентация на тему Гормоны
Презентация на тему Гормоны  Физико-химические процессы в гидросфере
Физико-химические процессы в гидросфере Атомы, вещества, молекулы
Атомы, вещества, молекулы Химические свойства и получение спиртов
Химические свойства и получение спиртов Презентация на тему Химия в повседневной жизни человека
Презентация на тему Химия в повседневной жизни человека  Интеллектуальные игры. Химия
Интеллектуальные игры. Химия Углеводы
Углеводы Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Химия элементов (лекция 4)
Химия элементов (лекция 4) Презентация на тему Карбоновые кислоты
Презентация на тему Карбоновые кислоты  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов