Содержание
- 2. Простые и комплексные соединения HgI2 + 2KI = K2[HgI4] SO3(т) + K2O(т) = = K2SO4(т) HgI2(т)
- 3. Комплексные (координационные) соединения Комплексами называют сложные частицы, образованные из реально существующих более простых, способные к самостоятельному
- 4. Координационная теория (1893 г. ) Внутренняя и внешняя сфера комплексного соединения [MLx]Yz Комплексообразователь M±ν Лиганды L±ν
- 5. Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет
- 6. Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl – КЧ 4, дент.1 [Al(H2O)6]Cl3 – КЧ 6, дент.1
- 7. Полидентатные лиганды
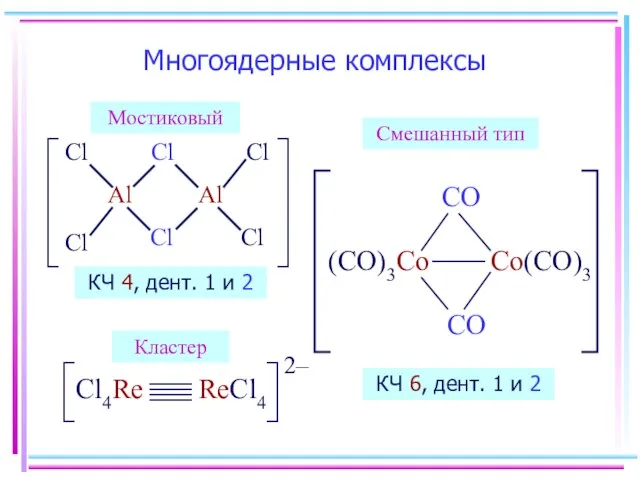
- 8. Многоядерные комплексы КЧ 4, дент. 1 и 2 Мостиковый Кластер Смешанный тип КЧ 6, дент. 1
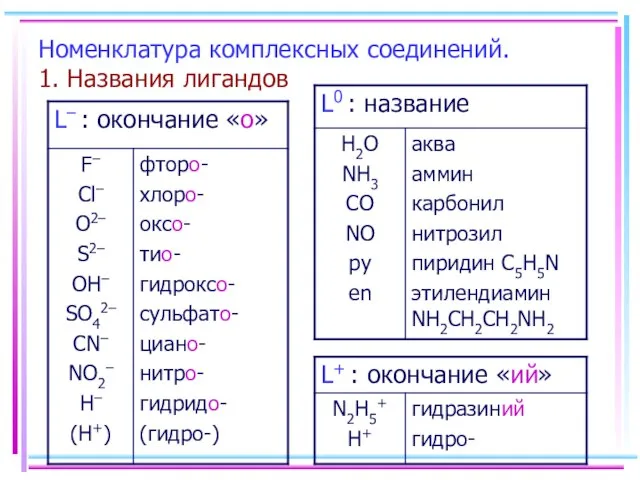
- 9. Номенклатура комплексных соединений. 1. Названия лигандов
- 10. 2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0 Число лигандов – греч. числит. 1 – (моно) 2
- 11. 3. Названия комплексных соединений А) Комплексы без внешней сферы [MLn] n → L → M (в
- 12. Названия комплексных соединений Б) Комплексный катион [MLn]+X– «анион катиона»: n → L → M(ст.ок.) Примеры: [AgI(NH3)2]OH
- 13. Названия комплексных соединений В) Комплексный анион X+[MLn]– «анион катиона»: анион n → L → M(ст.ок.)-«ат» Ag
- 14. Упражнения: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II) [K(H2O)6][Al(H2O)6](SO4)2 – сульфат гексаакваалюминия-гексааквакалия [(CO)5Mn-Mn(CO)5] – бис(пентакарбонилмарганец)
- 15. Комплексные соединения в растворах Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 ) Сильные электролиты [Pt(NH3)4]Cl2 =
- 16. [MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ) [H2O] = Const, р-р разбавленный Ступенчатая
- 17. Чем больше значение Ki(обр), тем сильнее смещено равновесие в сторону образования данного комплекса. … Ступенчатая константа
- 18. Полные (суммарные) константы образования Характеристика устойчивости комплексного соединения: чем больше значение βn(обр), тем более устойчив комплекс
- 19. Связь между полной и ступенчатой константами образования βn(обр) = K1(обр)·K2(обр)·K3(обр)·… ·Kn(обр)
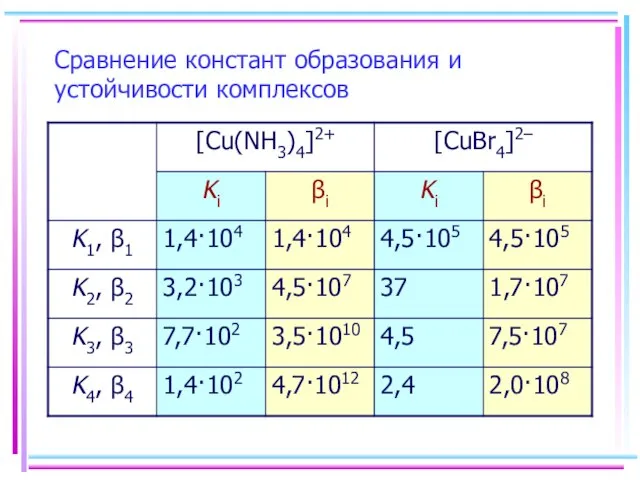
- 20. Сравнение констант образования и устойчивости комплексов
- 21. Сравнение устойчивости аммиачных комплексов Ступени комплексообразования [Cu(NH3)2]+ K2(обр) = 5,0·104 [Cu(NH3)]+ K1(обр) = 1,4·106 Природа комплексообразователя
- 23. Скачать презентацию
![Простые и комплексные соединения HgI2 + 2KI = K2[HgI4] SO3(т) + K2O(т)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-1.jpg)

![Координационная теория (1893 г. ) Внутренняя и внешняя сфера комплексного соединения [MLx]Yz](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-3.jpg)
![Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6] [Cr(CO)6] [Ni(NH3)6]2[Fe(CN)6] Примеры Внеш.сферы нет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-4.jpg)
![Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl – КЧ 4, дент.1 [Al(H2O)6]Cl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-5.jpg)

![2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0 Число лигандов – греч. числит.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-9.jpg)
![3. Названия комплексных соединений А) Комплексы без внешней сферы [MLn] n →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-10.jpg)
![Названия комплексных соединений Б) Комплексный катион [MLn]+X– «анион катиона»: n → L](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-11.jpg)
![Названия комплексных соединений В) Комплексный анион X+[MLn]– «анион катиона»: анион n →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-12.jpg)
![Упражнения: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II) [K(H2O)6][Al(H2O)6](SO4)2 – сульфат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-13.jpg)
![Комплексные соединения в растворах Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 )](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-14.jpg)
![[MLn] + H2O ⮀ [MLn-1(H2O)] + L0 (n = КЧ) [H2O] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-15.jpg)



![Сравнение устойчивости аммиачных комплексов Ступени комплексообразования [Cu(NH3)2]+ K2(обр) = 5,0·104 [Cu(NH3)]+ K1(обр)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/878637/slide-20.jpg)
 Углерод
Углерод Уровень С1 в ГИА
Уровень С1 в ГИА Гальванический элемент. Коррозия
Гальванический элемент. Коррозия Электролитическая диссоциация
Электролитическая диссоциация Почему химия важна в профессии ювелира?
Почему химия важна в профессии ювелира? Физические свойства водорода
Физические свойства водорода ОВР
ОВР Презентация на тему Метан и его свойства
Презентация на тему Метан и его свойства  Соли как производные кислот и оснований. Их состав и названия
Соли как производные кислот и оснований. Их состав и названия Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Электролиз растворов и расплавов неорганических и органических электролитов
Электролиз растворов и расплавов неорганических и органических электролитов Vodík
Vodík Определение Кофеина в Кофе
Определение Кофеина в Кофе d-элементы.Распространение в природе и основные материалы
d-элементы.Распространение в природе и основные материалы Химические вещества парабены
Химические вещества парабены теория строения
теория строения Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Презентация по Химии "Химический БРЕЙН-РИНГ"
Презентация по Химии "Химический БРЕЙН-РИНГ"  3bc28ca0711047a6880d20a6763f17db
3bc28ca0711047a6880d20a6763f17db Коррозия металлов, сплавов
Коррозия металлов, сплавов Вещества. Превращение веществ. Роль химии в жизни человека
Вещества. Превращение веществ. Роль химии в жизни человека Сплавы. 9 класс
Сплавы. 9 класс Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Хром. Месторождения
Хром. Месторождения Полимеры и пластмассы
Полимеры и пластмассы Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Сера, значение и применение
Сера, значение и применение