Содержание
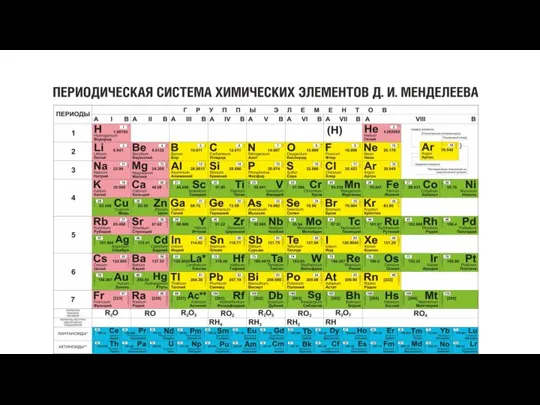
- 2. Мr(СН4) = Аr(С) + Аr(Н)·4 Относительная атомная масса (Ar) показывает, во сколько раз масса его атома
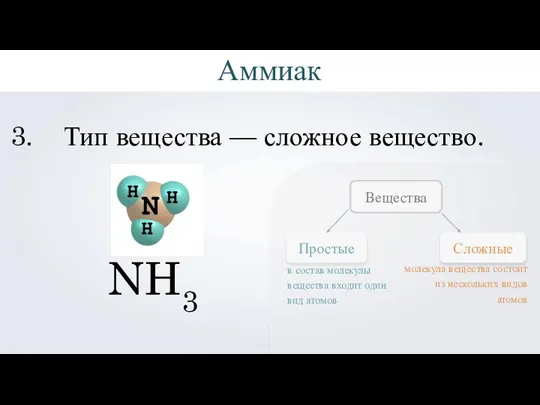
- 4. NH3 Вещество аммиак. Аммиак
- 5. NH3 Качественный состав — состоит из двух элементов: азота и водорода. N — азот H —
- 6. NH3 Тип вещества — сложное вещество. Простые Сложные Вещества в состав молекулы вещества входит один вид
- 7. NH3 Количественный состав вещества — в молекуле содержится 1 атом азота и 3 атома водорода. Аммиак
- 8. NH3 Аммиак Относительная молекулярная масса равна сумме атомной массы азота и атомной массы трёх молекул водорода.
- 9. Массовая доля химического элемента ω(Э) Массовая доля химического элемента рассчитывается как частное от деления суммарной относительной
- 10. Рассчитаем в процентах долю азота и водорода в аммиаке (NH3): NH3 ω(N) 82% ω(H) 18%
- 11. NaСl O 2 ω(Э) Cl 2 Н 2 O SiO2 Известны массовые доли химических элементов ω(Э),
- 12. Известно, что вещество состоит из: 0,4 массовой доли кальция (Са) 0,12 массовой доли углерода (С) 0,48
- 14. Скачать презентацию









 Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Альдегиды. Строение молекул
Альдегиды. Строение молекул Степень окисления в соединениях
Степень окисления в соединениях Вымораживание воды
Вымораживание воды Химическая связь
Химическая связь Алкены
Алкены Кристаллические решетки, вид связи и свойства веществ
Кристаллические решетки, вид связи и свойства веществ Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11) Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Повторение по химии (8 класс)
Повторение по химии (8 класс) teoria_Butlerova
teoria_Butlerova Что такое эксперимент?
Что такое эксперимент? Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Коллоидная химия
Коллоидная химия Ионная химическая связь
Ионная химическая связь Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14
Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14 Загрязнение почв пестицидами
Загрязнение почв пестицидами Полиамидное волокно-энант
Полиамидное волокно-энант Презентация на тему Теория электролитической диссоциации 8 класс
Презентация на тему Теория электролитической диссоциации 8 класс  Классификация реакций. Теория-кинетика
Классификация реакций. Теория-кинетика Химический анализ
Химический анализ Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Высокомолекулярные соеденения
Высокомолекулярные соеденения Химическая Кинетика
Химическая Кинетика Химический эквивалент. Лекция 2
Химический эквивалент. Лекция 2