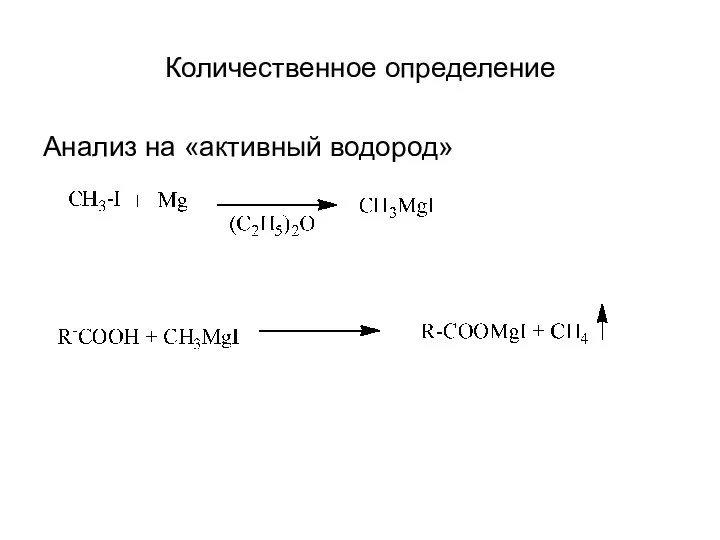
Слайд 2Количественное определение
Анализ на «активный водород»
Слайд 3Количественное определение
Нейтрализация щелочью (алкалиметрия)
R-COOH + NaOH= R-COONa+H2O
Гравиметрическое определение
R-COONa + AgNO3= R-COOAg +

NaNO3
R-COOAg (t oC)= Ag +CO2
Слайд 5Физические свойства кислот
С увеличением количества углерода (увеличение липофильности) органические кислоты хуже растворяются

в воде и лучше в органических растворителях.
Щелочные соли кислот растворяются хорошо в воде и не растворяются в органическом неполярном растворителе.
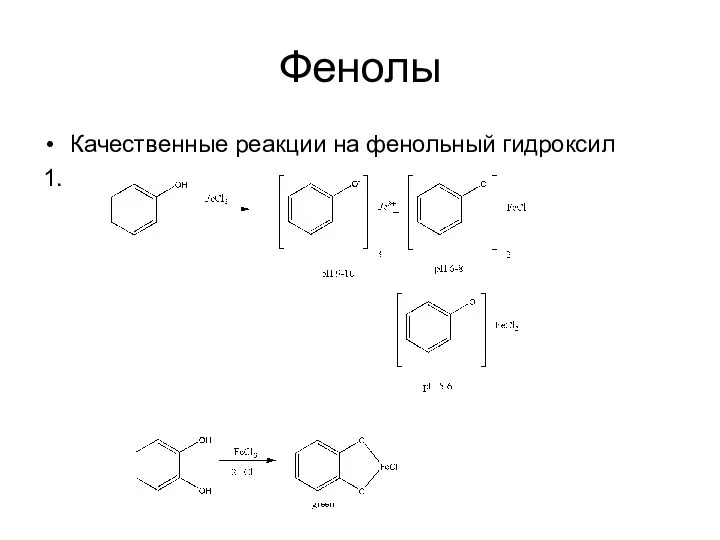
Слайд 6Фенолы
Качественные реакции на фенольный гидроксил
1.
Слайд 7Получение производных фенолов
Дериватизация (получение производных)- для идентификации по температуре плавления, количественного определения
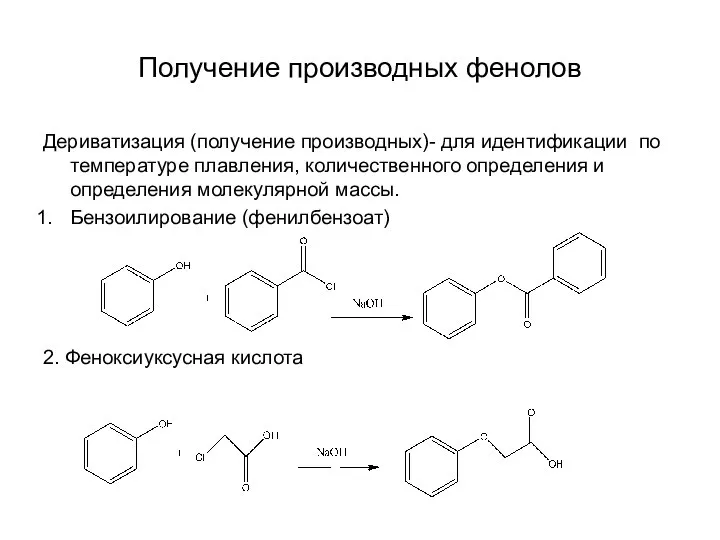
и определения молекулярной массы.
Бензоилирование (фенилбензоат)
2. Феноксиуксусная кислота
Слайд 81. Бромирование
2. Образование азокрасителя
Качественные реакции на основе электрофильного замещения в активированном ароматическом
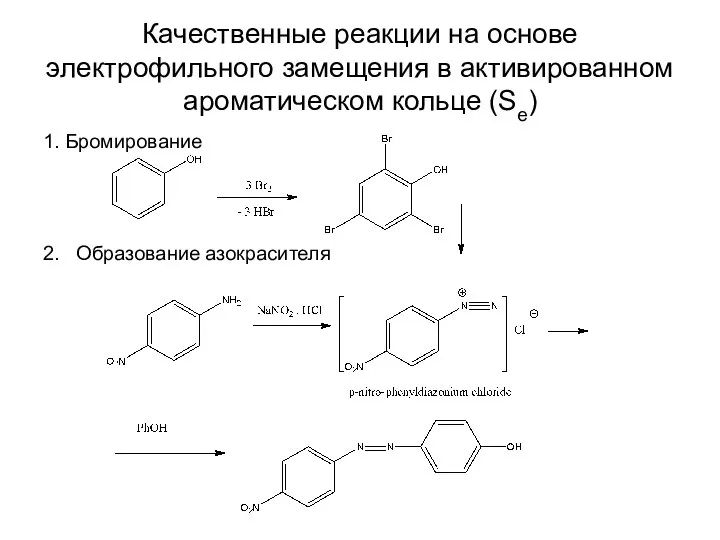
кольце (Se)
Слайд 93.Образование индофенола (фенол с хлорной кислотой и аммиаком или ароматическим амином)
4. Реакция
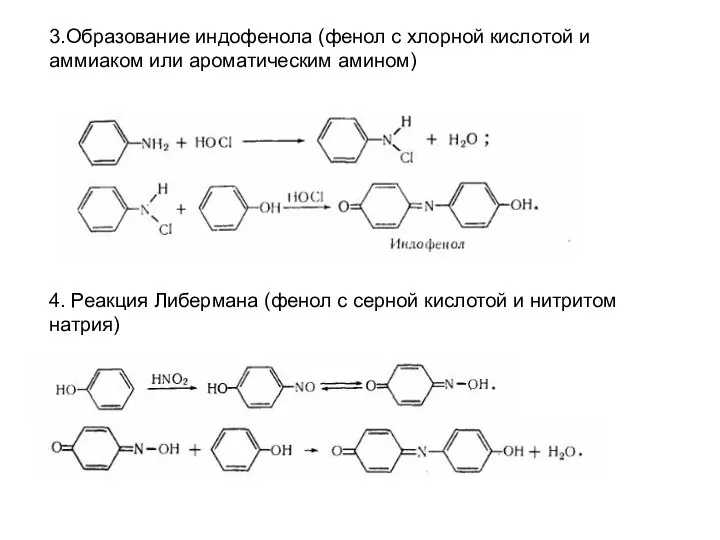
Либермана (фенол с серной кислотой и нитритом натрия)
Слайд 10
5. Взаимодействие с реактивом Миллона (нитрат ртути с азотистой кислотой)
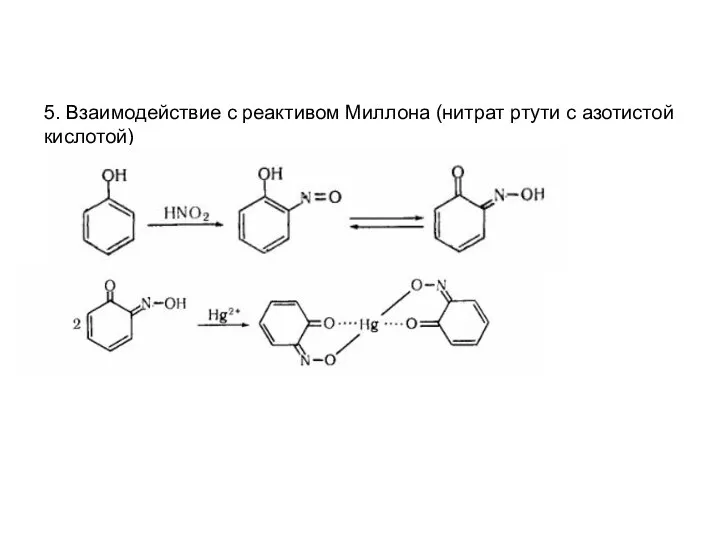
Слайд 116. Реакции образования трифенилметановых красителей (реактив Марки, смесь концентрированной серной кислоты и
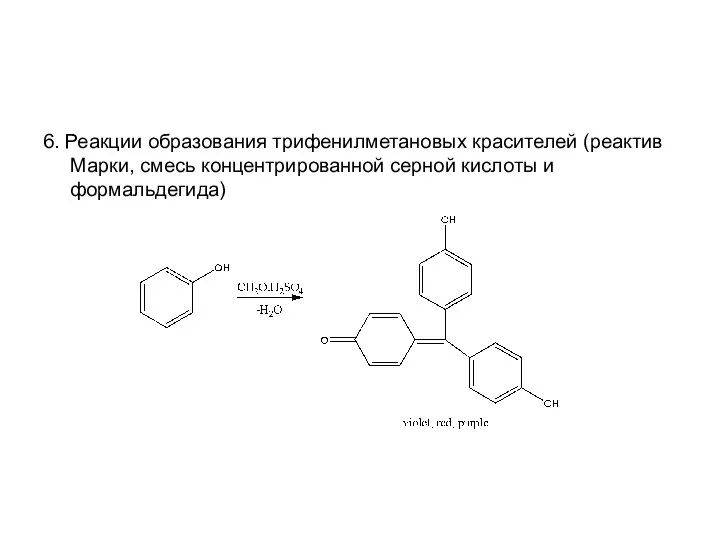
формальдегида)
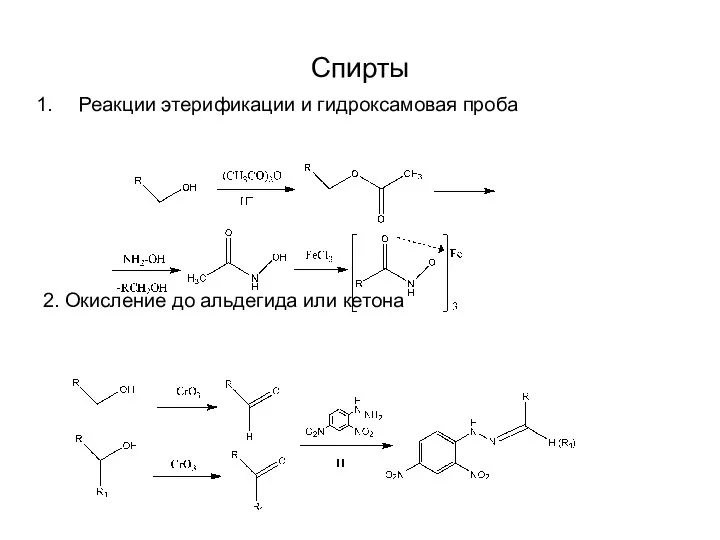
Слайд 12Спирты
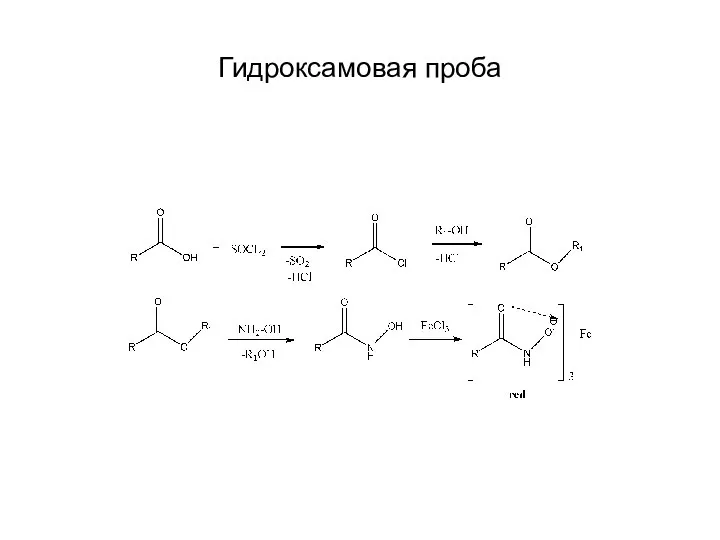
Реакции этерификации и гидроксамовая проба
2. Окисление до альдегида или кетона
Слайд 133. Ксантогенатная реакция (спирты с дисульфидом углерода в щелочной среде). Соли меди
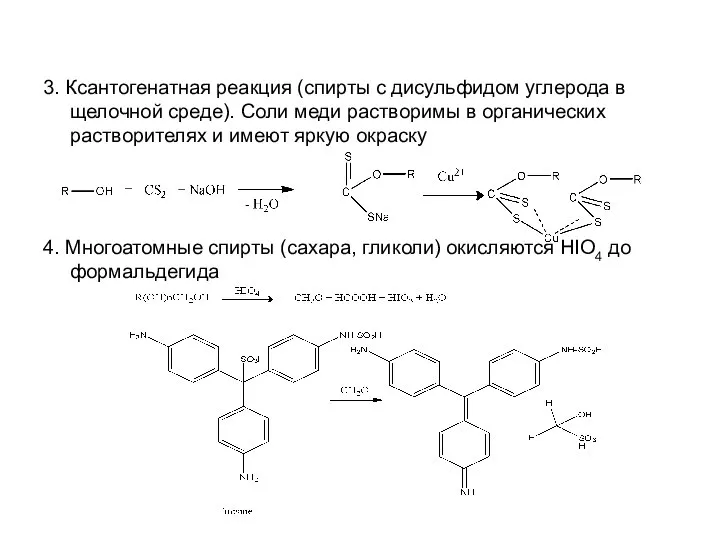
растворимы в органических растворителях и имеют яркую окраску
4. Многоатомные спирты (сахара, гликоли) окисляются HIO4 до формальдегида
Слайд 14Проба Лукаса: при реакции вторичного или третичного спирта при комнатной температуре (первичные
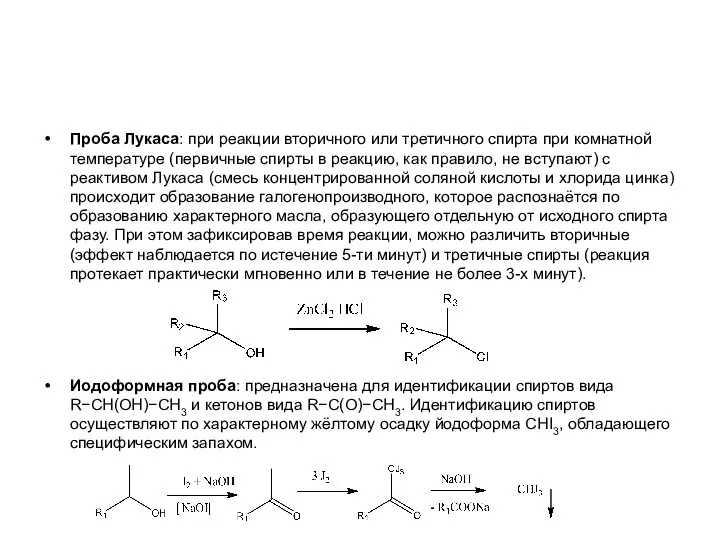
спирты в реакцию, как правило, не вступают) с реактивом Лукаса (смесь концентрированной соляной кислоты и хлорида цинка) происходит образование галогенопроизводного, которое распознаётся по образованию характерного масла, образующего отдельную от исходного спирта фазу. При этом зафиксировав время реакции, можно различить вторичные (эффект наблюдается по истечение 5-ти минут) и третичные спирты (реакция протекает практически мгновенно или в течение не более 3-х минут).
Иодоформная проба: предназначена для идентификации спиртов вида R−CH(OH)−CH3 и кетонов вида R−C(O)−CH3. Идентификацию спиртов осуществляют по характерному жёлтому осадку йодоформа CHI3, обладающего специфическим запахом.
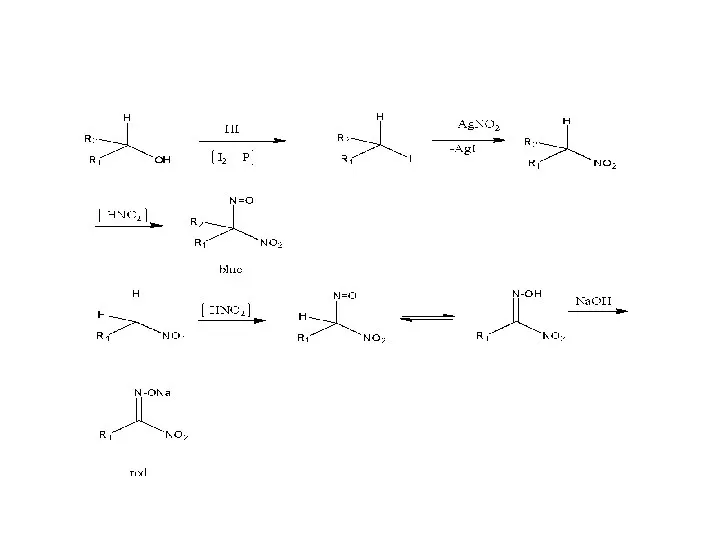
Слайд 15Тест Виктора Мейера : позволяет дифференцировать первичные, вторичные и третичные спирты по

реакции получаемых из них нитропроизводных с HNO2. На первой стадии спирты трансформируются в галогенопроизводные, которые, в свою очередь, превращаются в нитроалканы:
Далее взаимодействие с HNO2 делает возможными три варианта развития событий: раствор окрашивается в красный цвет (натриевая соль нитроловой кислоты — RC(NO2)=NONa), раствор окрашивается в синий цвет-псевдонитрол. Раствор остаётся бесцветным (реакция не идёт)-третичный спирт
Слайд 17Цератная проба: при взаимодействии спиртов с азотнокислым раствором гексанитратоцерата (IV) аммония, имеющим

жёлтую окраску, образуются переходные комплексы красного цвета, которые затем обесцвечиваются вследствие окисления спирта и перехода Ce (IV) в анион Ce (III). Для спиртов, нерастворимых в воде, используют растворы в диоксане или ацетонитриле (CH3CN)
Ce(NO3)4 + ROH= Ce(RO)(NO3)3 + HNO3
Слайд 18Азотсодержащие соединения
Соединения, содержащие четвертичный, третичный и реже вторичный атом азота и выделенные

из природного сырья исторически называются алкалоиды. (alkalis - щелочь)
Качественные реакции алкалоидов
Для установления подлинности алкалоидов используют общие, групповые и частные или специфические реакции.
Общие реакции основаны на способности алкалоидов как оснований давать простые или комплексные соли с различными, чаще комплексными кислотами, солями тяжелых металлов и др. Эти продукты, как правило, нерастворимы в воде, поэтому реактивы называют осадительными, а реакции - осадочными.
Общеалкалоидные осадительные реактивы:
1. Раствор иода в калия йодиде KI3 (реактив Люголя, Вагнера, Бушарда).
2. Раствор калия йодвисмутата K[BiI]4 (реактив Драгендорфа).
3. Раствор ртути йодида в калия йодиде K2[HgI]4(реактив Майера).
4. Раствор кадмия йодида в калия йодиде K2[CdI]4 (реактив Марме).
5. Фосфорномолибденовая кислота (реактив Зонненшгейна Н3РО4-12МоО3-2Н2О) - очень чувствительный реактив на алкалоиды и дает
аморфные осадки желтоватого цвета, которые через некоторое время приобретают синее и зеленое окрашивание (вследствие восстановления молибденовой кислоты).
6. Фосфорновольфрамовая кислота (реактив Шейблера H3PO4-12WoO3-2H2O).
7. Кремневольфрамовая кислота (реактив Бертрана SiO2-12WoO3-4H2O).
8. Насыщенный раствор пикриновой кислоты.
Слайд 19Взаимодействие никотина с реактивом Драгендорфа K[BiI4].
При действии на водный раствор никотина смесью
![Взаимодействие никотина с реактивом Драгендорфа K[BiI4]. При действии на водный раствор никотина](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180305/slide-18.jpg)
реактива Драгендорфа и раствора хлороводородной кислоты образуется оранжевый или кирпично-оранжевый осадок. Метод может быть использован и для количественного определения алкалоидов (гравиметрия, комплексонометрическое титрование)
Слайд 20Обнаружение ароматической амино- и нитрогруппы
1. Реагент Эрлиха (пара-диметиламинобензальдегид в серной или хлороводородной
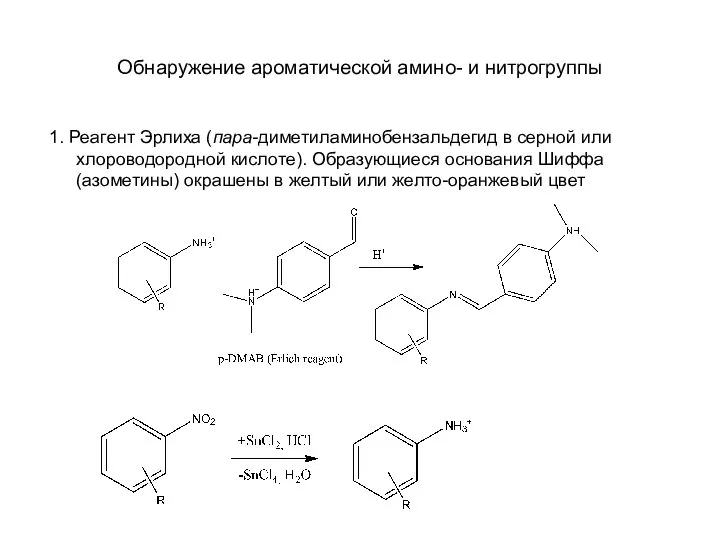
кислоте). Образующиеся основания Шиффа (азометины) окрашены в желтый или желто-оранжевый цвет
Слайд 212. Диазотирование и азосочетание (образование окрашенных азосоединений при взаимодействии соли диазония и
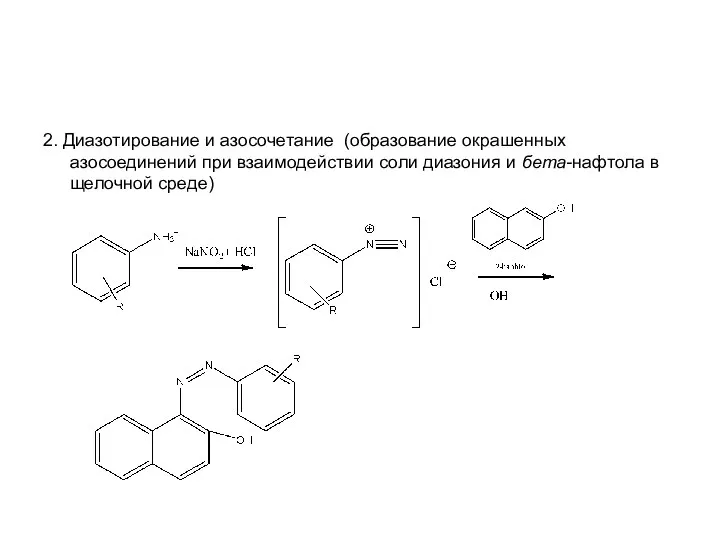
бета-нафтола в щелочной среде)
Слайд 22Качественная реакция на пиридиновый гетероцикл
Образование полиметиновых красителей, имеющих в зависимости от строения
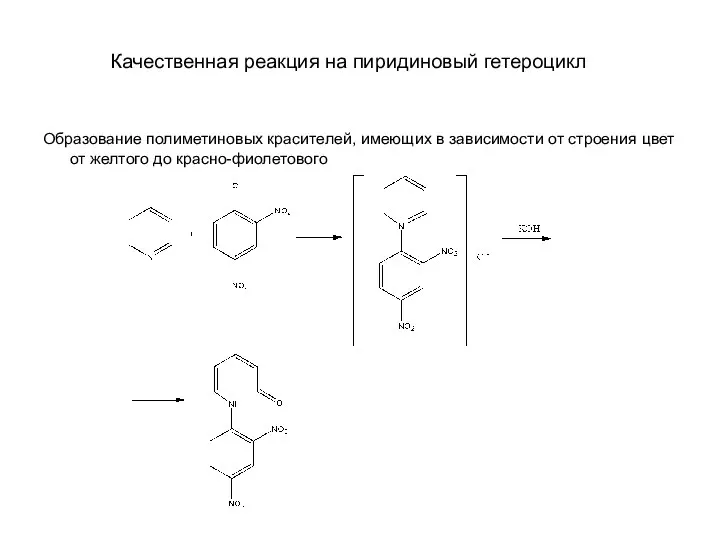
цвет от желтого до красно-фиолетового















![Взаимодействие никотина с реактивом Драгендорфа K[BiI4]. При действии на водный раствор никотина](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180305/slide-18.jpg)



 Вольфрам
Вольфрам Показатели обогащения
Показатели обогащения Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Амины. Аминокислоты. Белки. (Лекция 8)
Амины. Аминокислоты. Белки. (Лекция 8) Природные источники углеводорода
Природные источники углеводорода Мыло. Интересно об известном
Мыло. Интересно об известном Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Жиры (липиды)
Жиры (липиды) Презентация Продукции Opet (3)
Презентация Продукции Opet (3) Химия и повседневная жизнь человека. Почистим изделия из металлов
Химия и повседневная жизнь человека. Почистим изделия из металлов Термохимия. Задания
Термохимия. Задания Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Коррозия металлов
Коррозия металлов Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении
Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении Реакции ионного обмена
Реакции ионного обмена Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Общие химические свойства металлов
Общие химические свойства металлов Супер-химия. Викторина
Супер-химия. Викторина Язык химии. Знаки химических элементов
Язык химии. Знаки химических элементов Алканы
Алканы Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Сера
Сера Презентация на тему Алканы
Презентация на тему Алканы