Содержание
- 2. История открытия магния Соединения магния были известны человеку очень давно. Магнезитом (по-гречески Magnhsia oliqV) называли мягкий
- 3. Магний Магний (лат. Magnesium), Mg, химический элемент II группы периодической системы Менделеева, атомный номер 12, атомная
- 4. Магний
- 5. Распространение Магния в природе Магний - характерный элемент мантии Земли, в ультраосновных породах его содержится 25,9%
- 6. Распространение Магния в природе Брусит Доломит Магнезит Каинит Карналлит
- 7. Физические свойства Магния Магний - серебристо-белый металл с плотностью 1,74 г/см3, плавится при 651 град. С,
- 8. Применение Магния Основная часть добываемого магния используется для получения различных легких магниевых сплавов. В состав этих
- 9. Биологическая роль Магний — биогенный элемент, постоянно присутствующий в тканях всех организмов. Он входит в состав
- 10. Натрий
- 11. Открытие натрия В 1807 году, участвуя в конференции, английский химик Хемфри Деви сообщил о своем открытии
- 12. Физические свойства натрия и получение Натрий - серебристо-белый металл, его плотность - 0,97 г/см3, очень мягкий,
- 13. Нахождение в природе В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав
- 15. Скачать презентацию












 Химическая связь
Химическая связь Хімічні формули
Хімічні формули Электролитическая диссоциация
Электролитическая диссоциация Физические и химические свойства азота
Физические и химические свойства азота Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Химические реакции
Химические реакции Разбор заданий
Разбор заданий Соли
Соли Вольфрам
Вольфрам Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир Ископаемые углеводороды
Ископаемые углеводороды Радиоактивность. Тест
Радиоактивность. Тест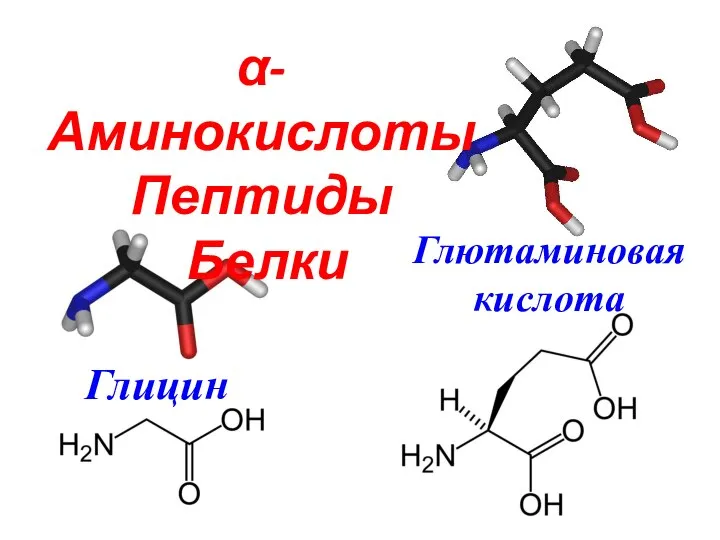 α-Аминокислоты
α-Аминокислоты Алканы. Этан - C₂H₆
Алканы. Этан - C₂H₆ Металлы. Тестирование
Металлы. Тестирование Реакции ионного обмена
Реакции ионного обмена Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка
Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Обмен белков и аминокислот. Синтез заменимых аминокислот
Обмен белков и аминокислот. Синтез заменимых аминокислот Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Интеллектуальная игра по химии «Металлы»
Интеллектуальная игра по химии «Металлы» Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу
Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу