Содержание
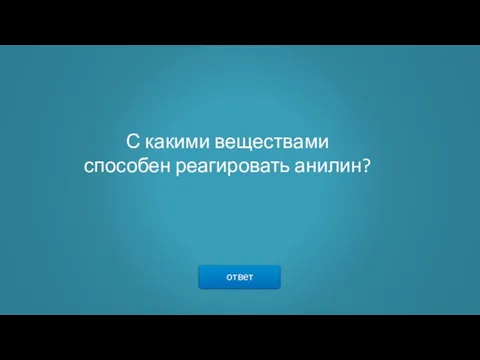
- 3. ответ С какими веществами способен реагировать анилин?
- 4. Анилин реагирует с сильными кислотами, образуя соли фениламмония C6H5NH3+, которые хорошо растворимы в воде, но нерастворимы
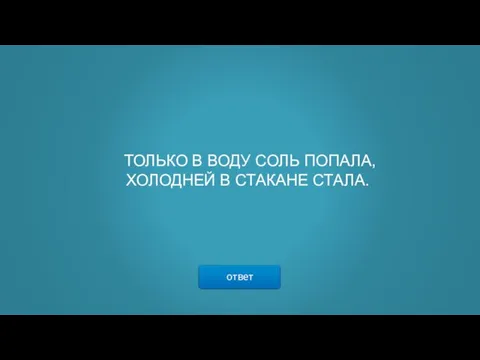
- 5. ТОЛЬКО В ВОДУ СОЛЬ ПОПАЛА, ХОЛОДНЕЙ В СТАКАНЕ СТАЛА. ответ
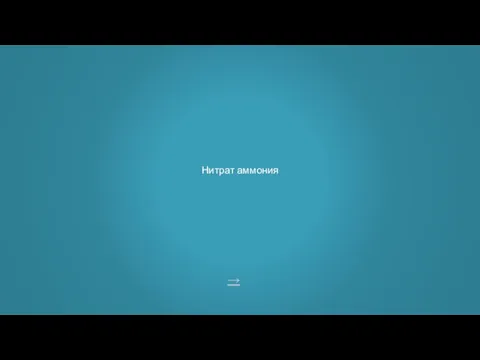
- 6. → Нитрат аммония
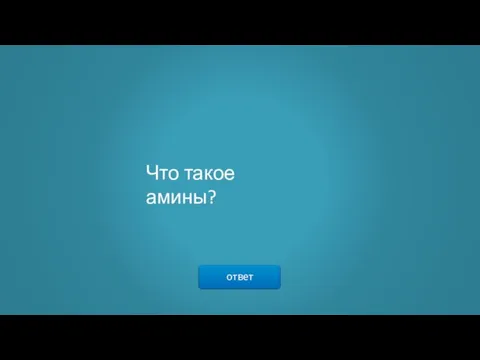
- 7. ответ Что такое амины?
- 8. → Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого несколько атомов водорода замещены на
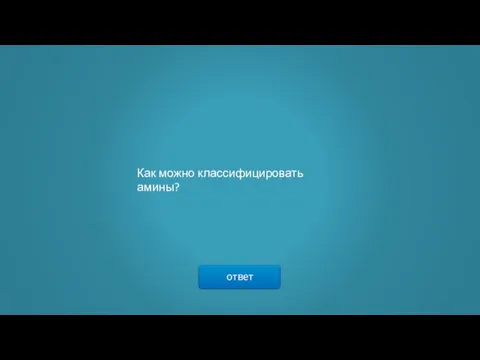
- 9. ответ Как можно классифицировать амины?
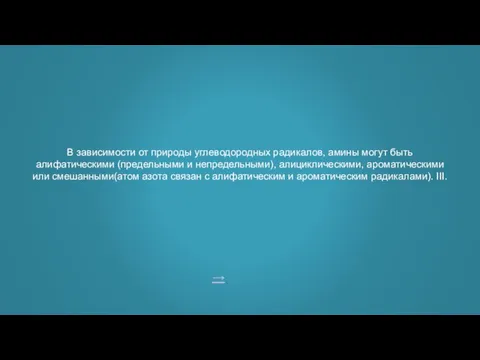
- 10. → В зависимости от природы углеводородных радикалов, амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими
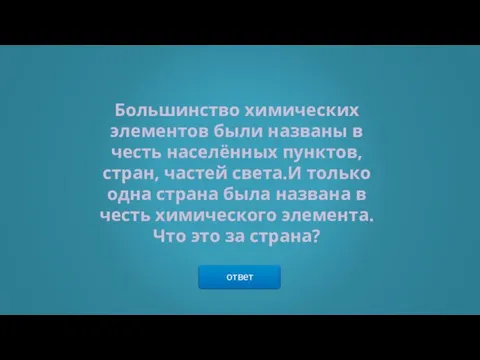
- 11. ответ Большинство химических элементов были названы в честь населённых пунктов, стран, частей света.И только одна страна
- 12. → АРГЕНТИНА
- 13. ответ 90 бал
- 14. →
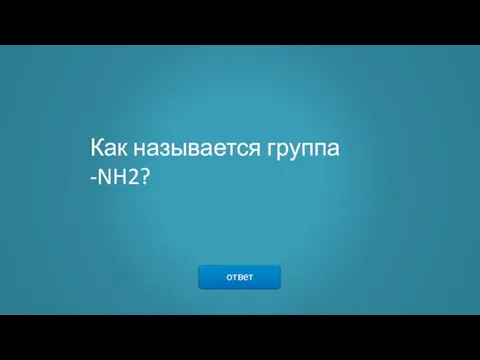
- 15. ответ Как называется группа -NH2?
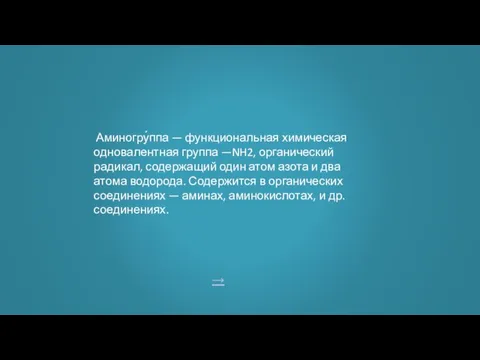
- 16. → Аминогру́ппа — функциональная химическая одновалентная группа —NH2, органический радикал, содержащий один атом азота и два
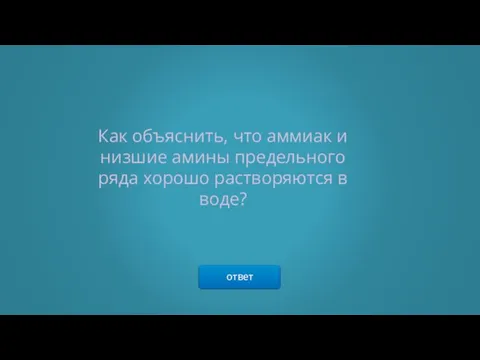
- 17. ответ Как объяснить, что аммиак и низшие амины предельного ряда хорошо растворяются в воде?
- 18. → Образованием водородной связи между молекулами аммиака/аминов и воды
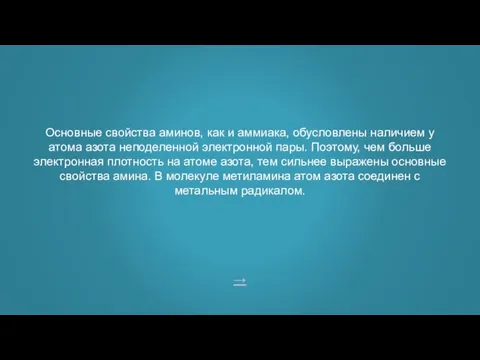
- 19. ответ Почему у метиламина более выражены основные свойства, чем у аммиака?
- 20. → Основные свойства аминов, как и аммиака, обусловлены наличием у атома азота неподеленной электронной пары. Поэтому,
- 21. ответ Какую окраску приобретает лакмус в растворе метиламина?
- 22. → изменяет окраску лакмуса на синюю; является донором электронной пары:горит
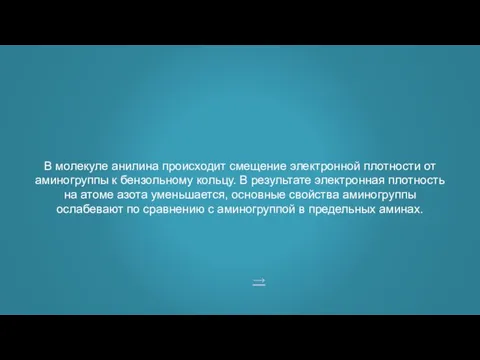
- 23. ответ В чем сущность взаимного влияния атомов в молекуле анилина?
- 24. → В молекуле анилина происходит смещение электронной плотности от аминогруппы к бензольному кольцу. В результате электронная
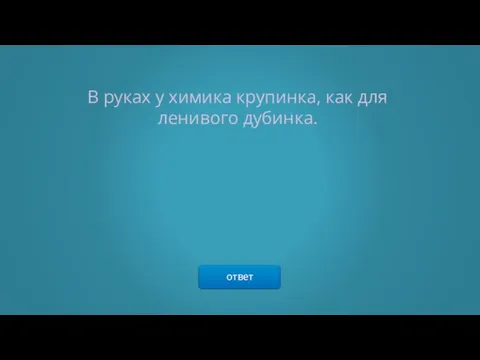
- 25. ответ В руках у химика крупинка, как для ленивого дубинка.
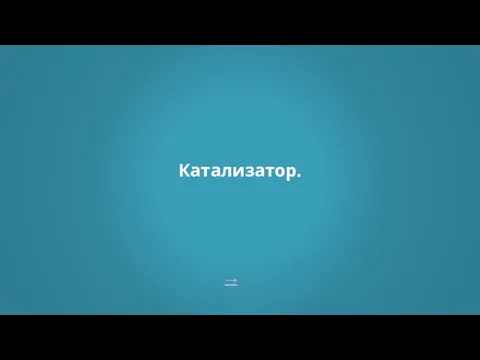
- 26. → Катализатор.
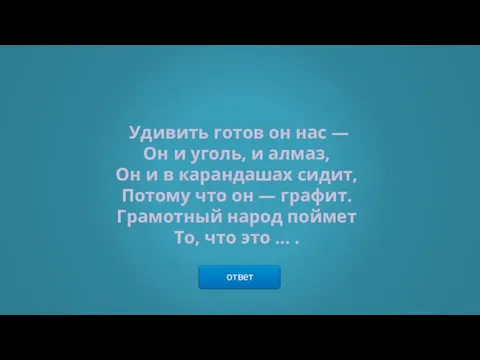
- 27. ответ Удивить готов он нас — Он и уголь, и алмаз, Он и в карандашах сидит,
- 28. → УГЛЕРОД
- 29. ответ Он безжизненным зовется, но жизнь без него не создается.
- 30. → АЗОТ
- 31. ответ «Она идет», «она прошла», Никто ни скажет, что пришла.
- 33. Скачать презентацию








 Спирты. Непредельные спирты
Спирты. Непредельные спирты Полимерные материалы и изделия
Полимерные материалы и изделия Золото. Физические свойства золота
Золото. Физические свойства золота Презентация на тему Алхимики
Презентация на тему Алхимики  Элементы формообразования (6 класс)
Элементы формообразования (6 класс) Транспорт веществ
Транспорт веществ Молекулярно-массовое распределение
Молекулярно-массовое распределение Основные понятия физической химии
Основные понятия физической химии Изомерия алкенов
Изомерия алкенов Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Основания. 8 класс
Основания. 8 класс Хлороводород и соляная кислота
Хлороводород и соляная кислота Наука ковала Победу. 1941-1945
Наука ковала Победу. 1941-1945 Первоначальные химические понятия
Первоначальные химические понятия Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия Гидролиз солей
Гидролиз солей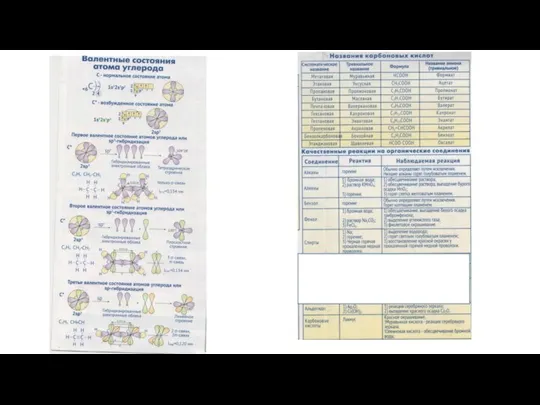 Валентные состояния атома углерода
Валентные состояния атома углерода Периодическая система
Периодическая система Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Коррозия металла
Коррозия металла Классы неорганических веществ
Классы неорганических веществ Гідроліз солей
Гідроліз солей Презентация на тему Химия в медицине
Презентация на тему Химия в медицине  Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Химия в жизни общества
Химия в жизни общества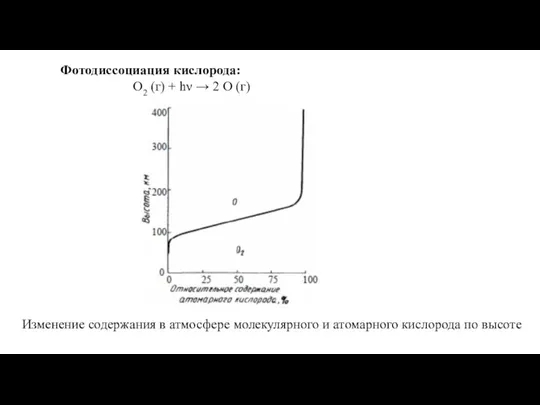 Фотодиссоциация кислорода
Фотодиссоциация кислорода Очистка рабочих электродов
Очистка рабочих электродов Оксиды
Оксиды