Содержание
- 3. На внешнем энергетическом уровне у большинства неметаллов (кроме водорода, гелия и бора) расположено от 4 до
- 4. Неметаллы в роли окислителей Неметаллы в роли восстановителей 2K + S = K2S 2Mg + O2
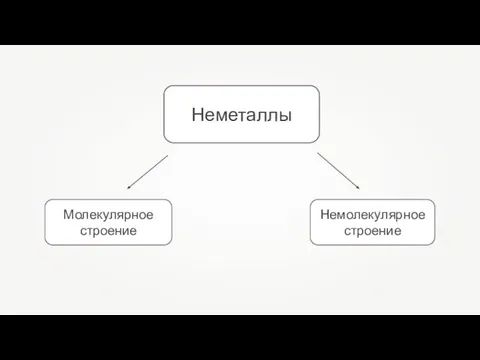
- 6. Неметаллы
- 7. Газообразные: H2, O2, F2, Cl2, N2, благородные газы Жидкие: Br2 Твёрдые: B, C, Si, P, S,
- 8. Для неметаллов характерно широкое разнообразие окрасок. Графит Бром Йод Хлор
- 9. -272 оС 3800 оС Температуры плавления неметаллов
- 10. Неметаллы способны образовывать два типа кристаллических решёток — молекулярные и атомные.
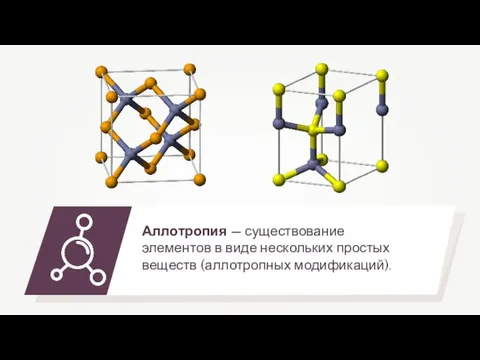
- 11. Аллотропия — существование элементов в виде нескольких простых веществ (аллотропных модификаций).
- 17. Воздух, свободный от переменных и случайных составных частей, прозрачен, лишен цвета, вкуса и запаха. При нормальных
- 19. Скачать презентацию











 Кислород. 8 класс
Кислород. 8 класс Удивительный мир металлов
Удивительный мир металлов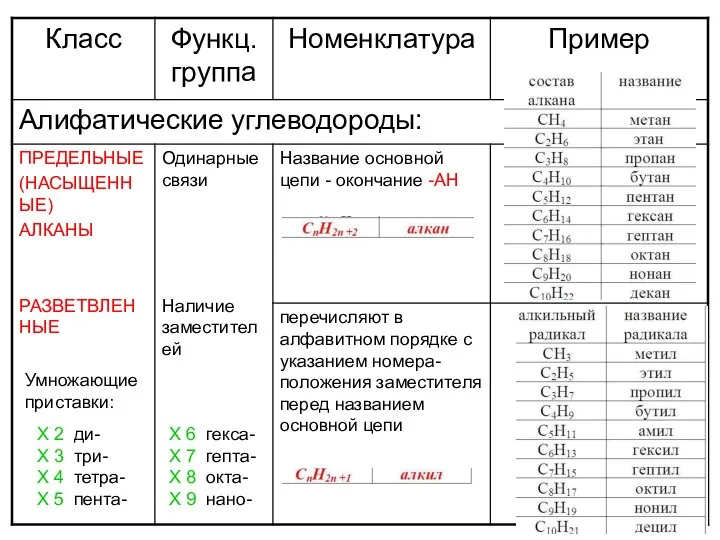 Алифатические углеводороды
Алифатические углеводороды Типичные окислители. 9 класс
Типичные окислители. 9 класс Составы и температуры плавления смесей
Составы и температуры плавления смесей Процес сушіння тонкодисперсної пасти діоксиду титану
Процес сушіння тонкодисперсної пасти діоксиду титану Железо - основа всего мира
Железо - основа всего мира Классификация неорганических соединений
Классификация неорганических соединений Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Стекло. Виды стекла
Стекло. Виды стекла Ліпіди і їх роль в життєдіяльності клітини
Ліпіди і їх роль в життєдіяльності клітини Презентация на тему Платина
Презентация на тему Платина  тэд — без анимации(1)
тэд — без анимации(1) Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Химия природная или синтетическая. За и против
Химия природная или синтетическая. За и против Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Спирт – это жизненная необходимость или страшное зло…
Спирт – это жизненная необходимость или страшное зло… Презентация на тему Многообразие карбоновых кислот
Презентация на тему Многообразие карбоновых кислот  Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Домашняя работа по теме Фенол
Домашняя работа по теме Фенол Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Презентация на тему Жиры (9 класс)
Презентация на тему Жиры (9 класс)  Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Кислород
Кислород