Содержание
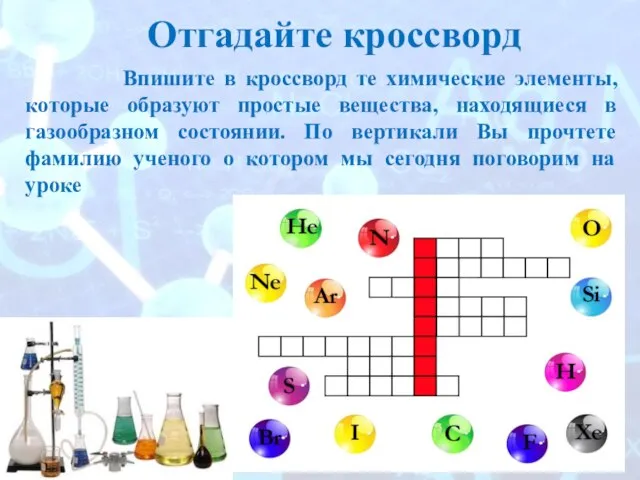
- 2. Впишите в кроссворд те химические элементы, которые образуют простые вещества, находящиеся в газообразном состоянии. По вертикали
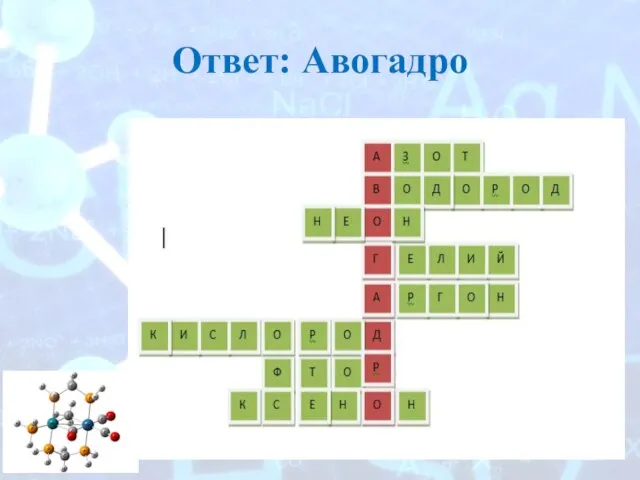
- 3. Ответ: Авогадро
- 4. Тема урока: Закон Авогадро. Молярный объем газов Урок химии, 8 класс Выполнила: Данькова Т.В. МКОУ «Майская
- 5. Цель урока: Сформировать понятие о молярном объеме газов. Научить производить расчеты, используя закон Авогадро и следствия
- 6. обучающие: обеспечить в ходе урока усвоение и первичное закрепление новых понятий; знать закон Авогадро, молярный объем
- 7. Открытие и формулировка закона Итальянский ученый Амедео Авогадро обратил внимание на то, что все газы одинаково
- 8. Закон Авогадро Амедео Авогадро (1776 – 1856) В равных объёмах различных газов при одинаковых условиях содержится
- 9. Объяснение закона Авогадро 1 следствие При н.у. 1 моль любого газа занимает объем, равный 22,4 л
- 10. Vm = 22,4 л/моль Vm = V/n Нормальные условия (н.у.): p = 1 атм (101,325 кПа)
- 11. Объяснение закона Авогадро 2 следствие Т.к. 1 моль газа при н.у. занимает V=22,4, зная массу 1
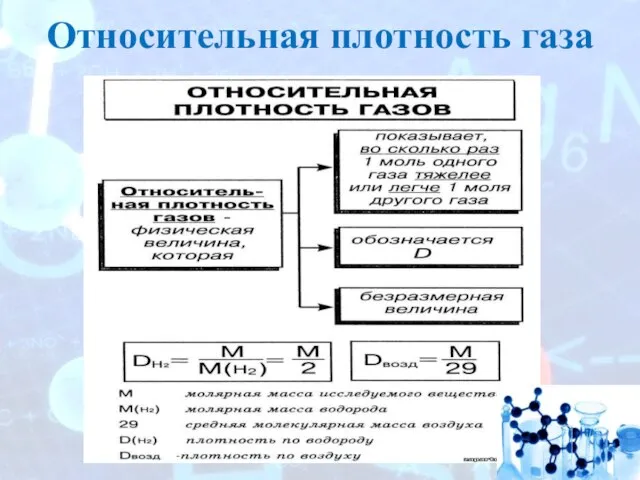
- 12. Относительная плотность газа
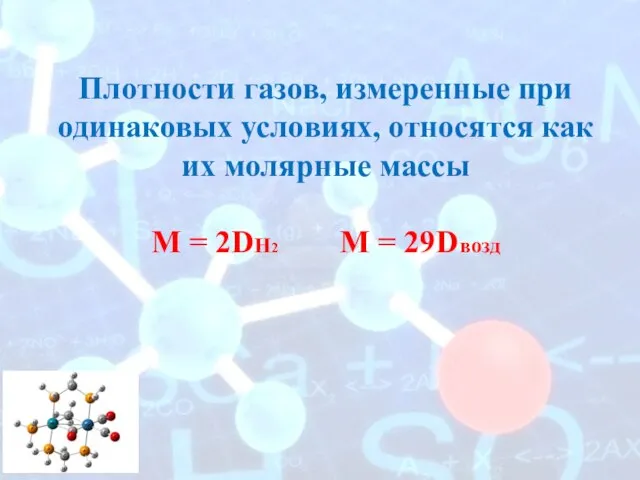
- 13. Плотности газов, измеренные при одинаковых условиях, относятся как их молярные массы M = 2DH2 M =
- 14. Закрепление изученного материала Решите задачи: Какой объем занимает 0,2 моль N2 при н.у.? Дано: Решение: Vm
- 15. Закрепление изученного материала Решите задачи: Какое количество вещества содержит водород объемом 33,6 л при н.у.? Дано:
- 17. Скачать презентацию










 Белки
Белки Формы записи химического потенциала в различных фазах
Формы записи химического потенциала в различных фазах Движение электрона в атоме
Движение электрона в атоме Удивительные приборы: Термометр
Удивительные приборы: Термометр Стратегия обучения решению задач по химии
Стратегия обучения решению задач по химии Кислотність бджолиного обніжжя
Кислотність бджолиного обніжжя Повторение пройденного
Повторение пройденного Презентация на тему Руды металлов
Презентация на тему Руды металлов  Закон эквивалентов
Закон эквивалентов Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք
Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք Вариативные задачи по химии различных типов в тестовой форме
Вариативные задачи по химии различных типов в тестовой форме Ионные равновесия в растворах
Ионные равновесия в растворах Кислород и водород. Сходства и различия
Кислород и водород. Сходства и различия Презентация на тему Законы электролиза
Презентация на тему Законы электролиза 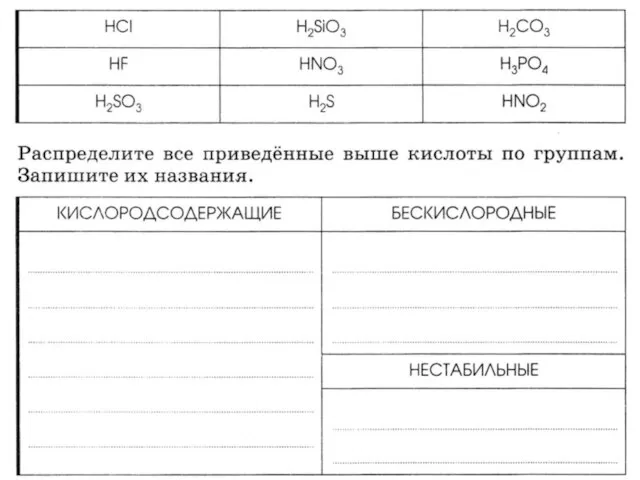 Соли. Классификация сложных веществ
Соли. Классификация сложных веществ 10-2 основные положения теории Бутлерова
10-2 основные положения теории Бутлерова Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Химия и искусство: техника офорт
Химия и искусство: техника офорт Тренажер Химическая азбука для учащихся 8 класса
Тренажер Химическая азбука для учащихся 8 класса Классификация органических веществ
Классификация органических веществ Строение атома. История открытия
Строение атома. История открытия Фараонова Змея
Фараонова Змея Презентация на тему Влияние пищевых добавок на здоровье человека
Презентация на тему Влияние пищевых добавок на здоровье человека  Металлы
Металлы Валентность химических элементов. Определение валентности элементов по формулам их соединений
Валентность химических элементов. Определение валентности элементов по формулам их соединений α-Аминокислоты
α-Аминокислоты Кислота. Карбоновые кислоты
Кислота. Карбоновые кислоты Презентация на тему Полимеры. Каучуки. Резина
Презентация на тему Полимеры. Каучуки. Резина