Содержание
- 2. История открытия теории электролитической диссоциации В 1800 г. Карлейль и Никольс впервые произвели разложение воды действием
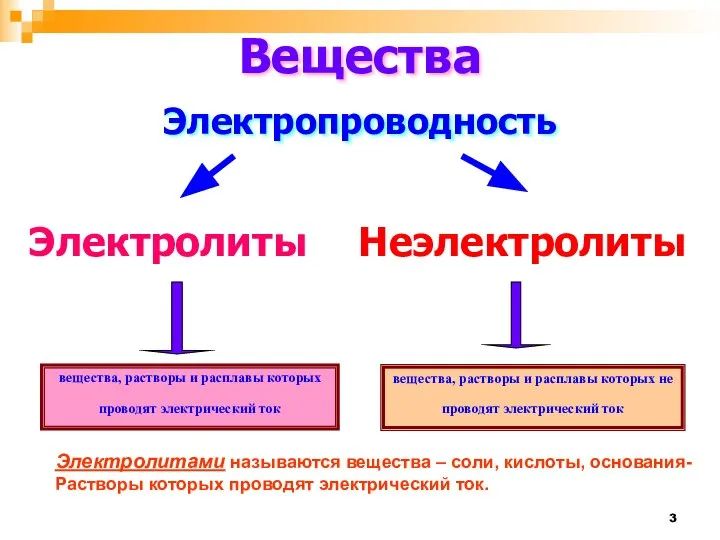
- 3. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
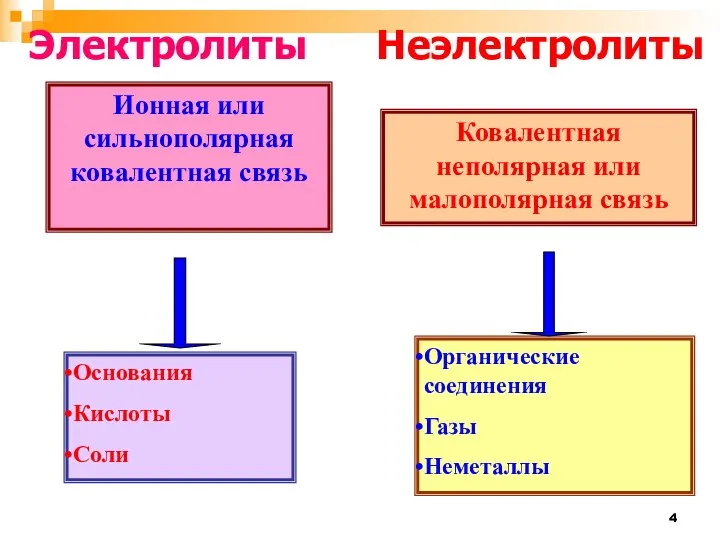
- 4. Ионная или сильнополярная ковалентная связь Основания Кислоты Соли Ковалентная неполярная или малополярная связь Органические соединения Газы
- 5. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая
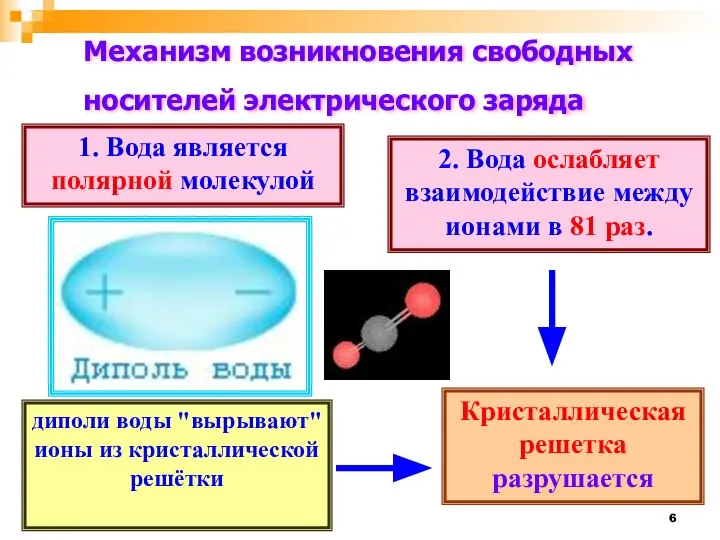
- 6. Механизм возникновения свободных носителей электрического заряда 1. Вода является полярной молекулой 2. Вода ослабляет взаимодействие между
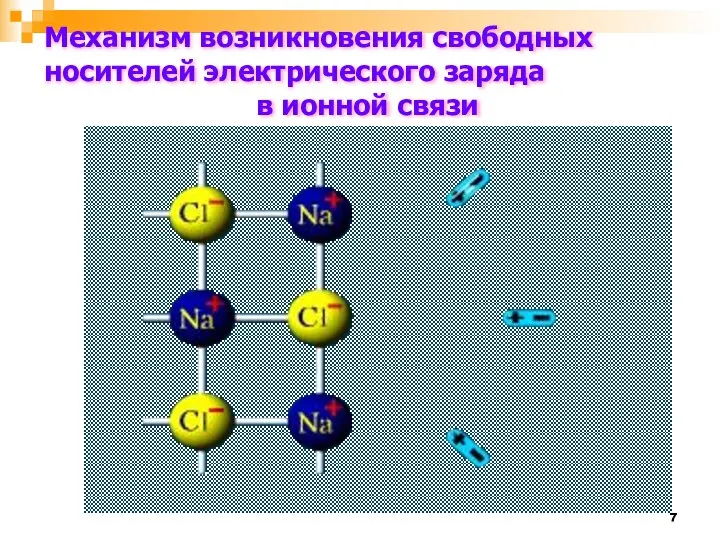
- 7. Механизм возникновения свободных носителей электрического заряда в ионной связи
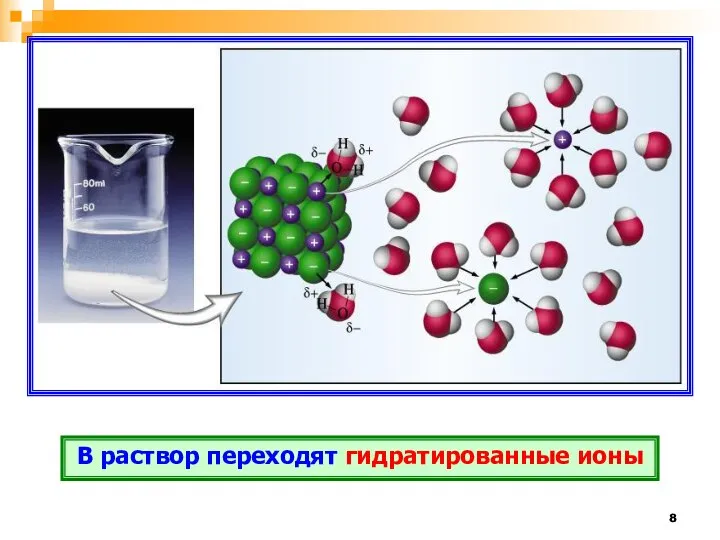
- 8. В раствор переходят гидратированные ионы
- 9. Механизм возникновения свободных носителей электрического заряда в КПС
- 10. Диссоциация – процесс расщепления веществ на ионы противоположного знака. Д Электролиты- вещества с ионной проводимостью.
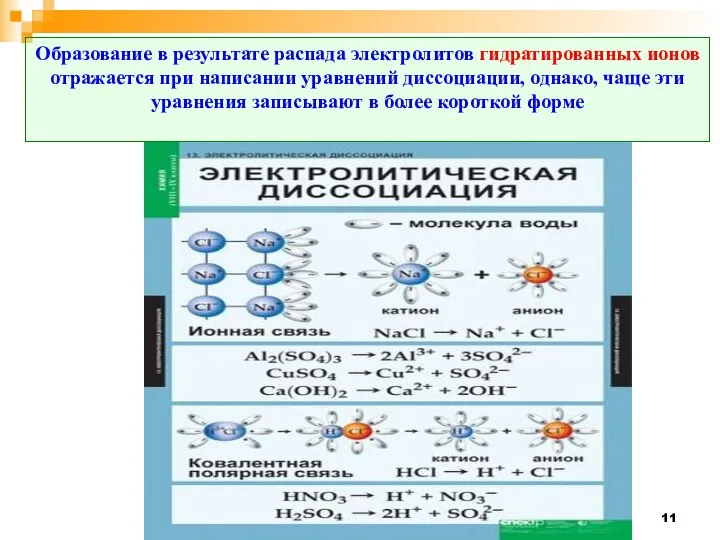
- 11. Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения
- 12. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
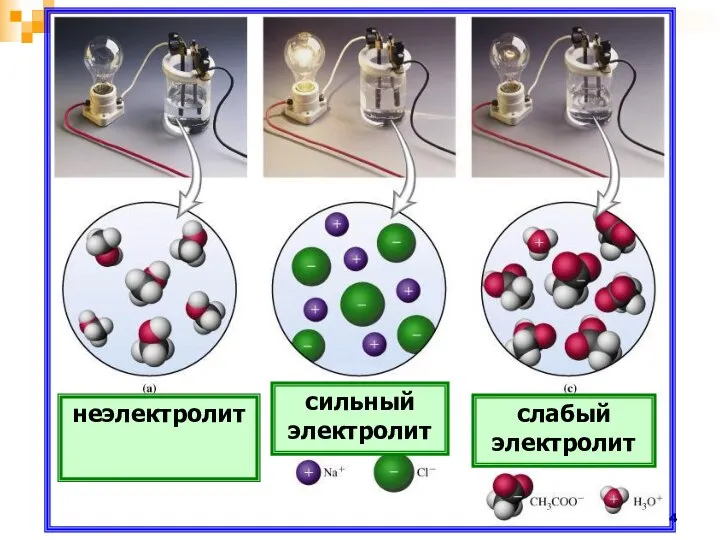
- 14. неэлектролит сильный электролит слабый электролит
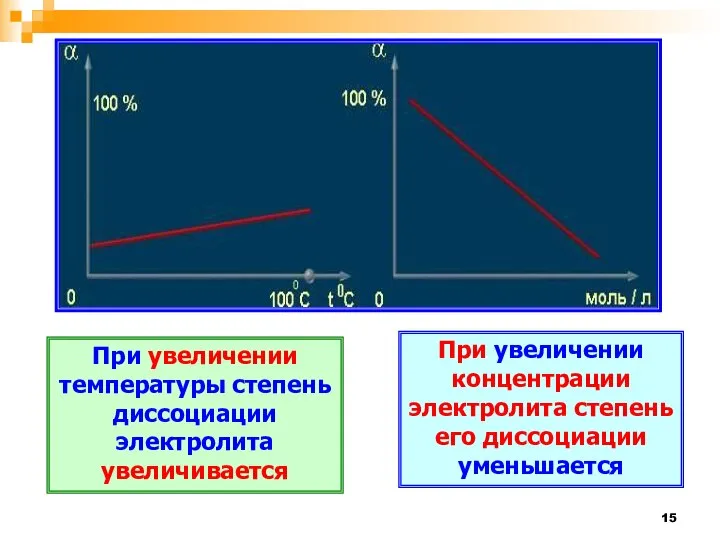
- 15. При увеличении температуры степень диссоциации электролита увеличивается При увеличении концентрации электролита степень его диссоциации уменьшается
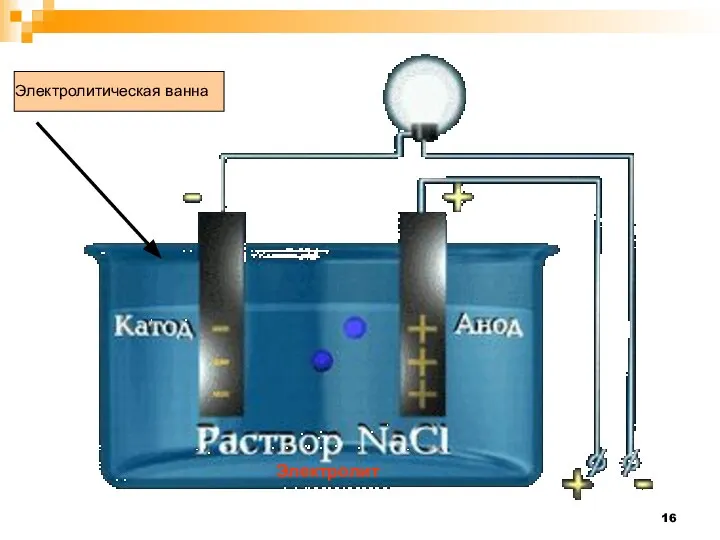
- 16. Электролитическая ванна Электролит
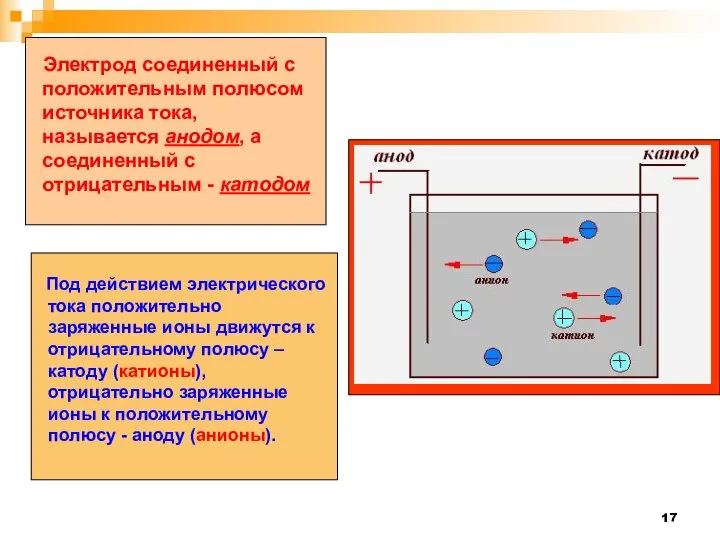
- 17. Электрод соединенный с положительным полюсом источника тока, называется анодом, а соединенный с отрицательным - катодом Под
- 18. Катионы- это положительные ионы. Анионы- это отрицательные ионы.
- 19. Кислоты- это электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка: HCI= H + CI HNO3=
- 20. Основания- это электролиты, диссоциирующие на катион металла и гидроксид ионы: NaOH=Na + OH Са(OH)2= Ca +2OH
- 21. Соли- это электролиты, диссоциирующие на катион металла и анион кислотного остатка: CuSO4 = Cu +SO4 K3PO4=
- 23. Скачать презентацию










 Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста
Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области
ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области Сигнальные молекулы
Сигнальные молекулы Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method
Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method Железо Fe
Железо Fe Спирты
Спирты Презентация на тему Углекислый газ CO2
Презентация на тему Углекислый газ CO2  Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Ксилит. Получение
Ксилит. Получение Простые вещества – неметаллы. Получение и химические свойства неметаллов
Простые вещества – неметаллы. Получение и химические свойства неметаллов Химические равновесия в растворах. Лекция 2. Часть 1
Химические равновесия в растворах. Лекция 2. Часть 1 Химические методы анализа. Гравиметрический метод анализа
Химические методы анализа. Гравиметрический метод анализа Удивительный мир химических задач
Удивительный мир химических задач Продукты и процессы переработки нефти
Продукты и процессы переработки нефти Введение Химия. Вещество. Свойства вещества
Введение Химия. Вещество. Свойства вещества Многоатомные спирты
Многоатомные спирты Типы химических реакций в органической химии
Типы химических реакций в органической химии Товароведение и экспертиза пластических масс и изделий из них
Товароведение и экспертиза пластических масс и изделий из них Каскадный синтез пептидов
Каскадный синтез пептидов Степени окисления химических элементов
Степени окисления химических элементов Основные обозначения. Основные понятия. Практическая работа № 2
Основные обозначения. Основные понятия. Практическая работа № 2 Классы неорганических веществ
Классы неорганических веществ Практическая работа 1.Скорость химической реакции
Практическая работа 1.Скорость химической реакции Строение атома
Строение атома Состав и свойства нефти. Химический состав нефтяной смеси
Состав и свойства нефти. Химический состав нефтяной смеси Нефть и её переработка
Нефть и её переработка Химическая мастерская
Химическая мастерская Азот и его соединения
Азот и его соединения