Содержание
- 2. Общая характеристика металлов 27.09.2022
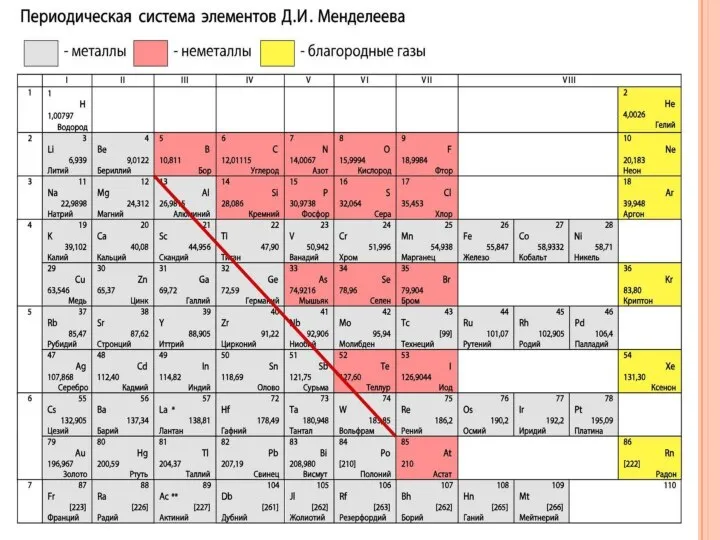
- 3. Количество металлов среди всех химических элементов
- 4. Расположение элементов – металлов в ПСХЭ: 1 группа главная подгруппа – щелочные металлы 2 группа главная
- 6. Большая часть металлов существует в природе в виде минеральных образований - руд Некоторые неактивные металлы существуют
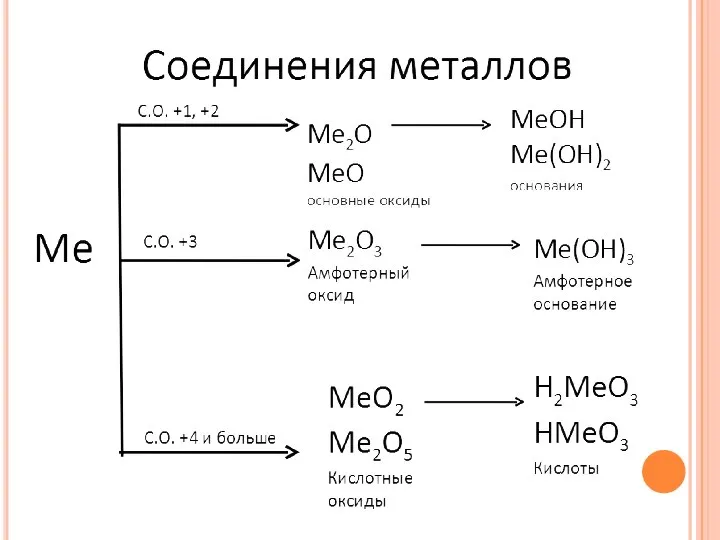
- 8. Металлы – это химические элементы, атомы которых отдают электроны внешнего ( предвнешнего) электронного слоя, превращаясь в
- 9. Главные особенности элементов металлов. Число валентных электронов (1-3 ). Сравнительно большие радиусы атомов. Небольшие значения электроотрицательности
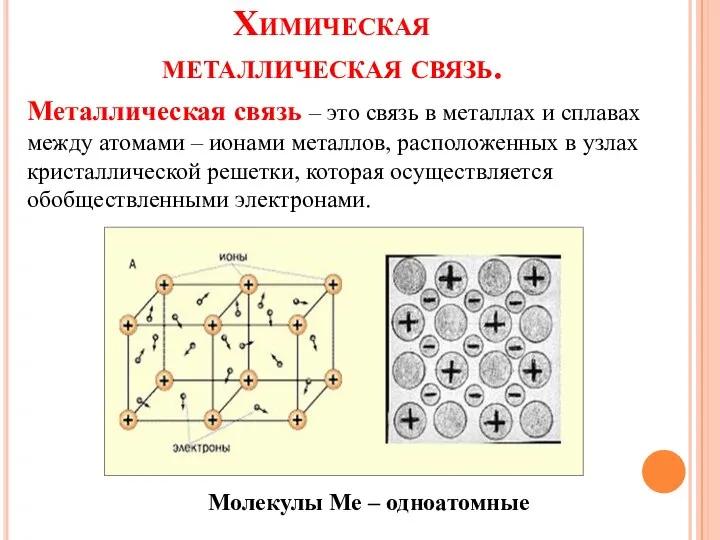
- 12. Химическая металлическая связь. Металлическая связь – это связь в металлах и сплавах между атомами – ионами
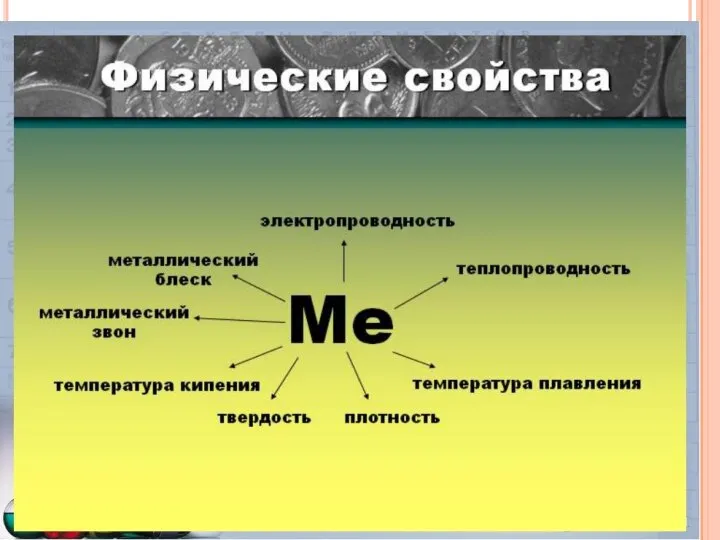
- 13. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Пластичность – смещение слоев ионов под
- 14. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Металлический блеск – наличие свободных электронов.
- 15. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Электро- и теплопроводность – обусловлена нахождением
- 16. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Твердость –свойство материала сопротивляться внедрению более
- 17. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Твердость –свойство материала сопротивляться внедрению более
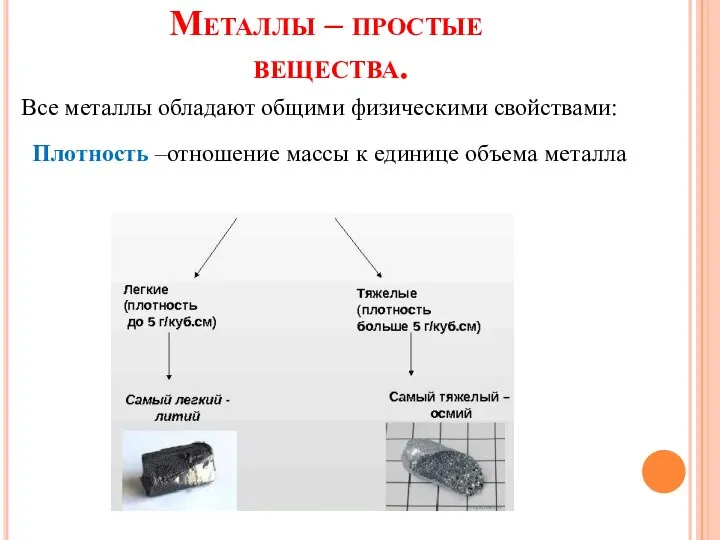
- 18. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Плотность –отношение массы к единице объема
- 19. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Цвет металла
- 20. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Температура плавления
- 22. Домашнее задание 1. Выучить записи в тетради 2. Дать характеристику металлов
- 23. Взаимодействие металлов с галогенами o +2 -1 2Са + Н 2О → 2Сa(ОН) o +3 -1
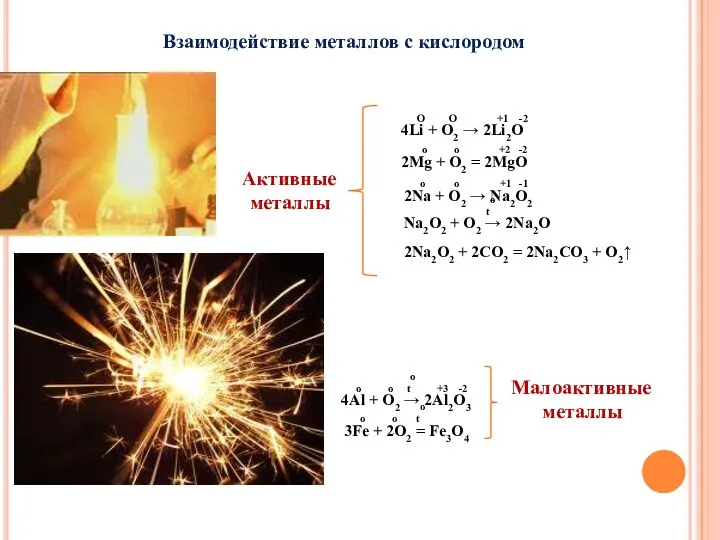
- 24. Взаимодействие металлов с кислородом Активные металлы O O +1 -2 4Li + O2 → 2Li2O o
- 25. o +1 -1 +2 -1 o Zn + 2HCl → ZnCl2 + H2 Взаимодействие металлов с
- 26. Химические свойства металлов 1. Все металлы проявляют только восстановительные свойства 2. Атомы металлов легко отдают электроны
- 27. Применение металлов
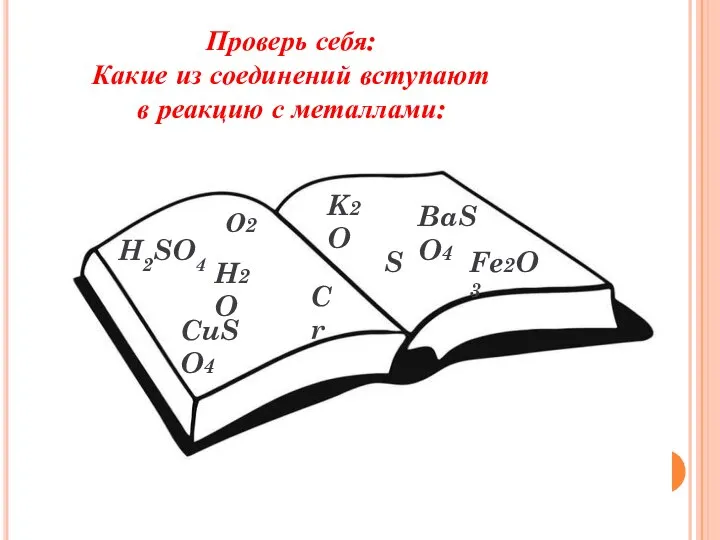
- 28. Проверь себя: Какие из соединений вступают в реакцию с металлами: О2 K2O CuSO4 H2O S BaSO4
- 30. Скачать презентацию




















 4. Диаграмма железо-углерод
4. Диаграмма железо-углерод Электролитическая диссоциация
Электролитическая диссоциация Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Решение задач на нахождение молекулярной формулы газообразного алкана
Решение задач на нахождение молекулярной формулы газообразного алкана Электролитическая диссоциация (9 класс)
Электролитическая диссоциация (9 класс) Металлы. Повторение
Металлы. Повторение Раздел 1
Раздел 1 Арены. Бензол
Арены. Бензол Презентация на тему Электролиз расплавов и растворов
Презентация на тему Электролиз расплавов и растворов  Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Количество вещества
Количество вещества Химия. Спирты
Химия. Спирты Химическая промышленность
Химическая промышленность Судын оксидтермен реакциясы
Судын оксидтермен реакциясы Типы кристаллических решеток
Типы кристаллических решеток Альдегиды и кетоны
Альдегиды и кетоны Презентация на тему Теория А. М. Бутлерова
Презентация на тему Теория А. М. Бутлерова  ОВР
ОВР Продолжение истории: 1933 год, Ленинград (Питер)
Продолжение истории: 1933 год, Ленинград (Питер) Первые попытки классификации химических элементов
Первые попытки классификации химических элементов Стехиометрические законы химии
Стехиометрические законы химии Углерод и его соединения
Углерод и его соединения Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Три агрегатных состояния веществ
Три агрегатных состояния веществ