Слайд 3Характеристика элемента – металла по положению в ПСХЭ Д.И.Менделеева
Li B 1.

Металлы находятся в I-III группе главной
подгруппе (искл. H -1e, Hе-2e, B-3e),
а также в I-VIII группах побочной подгруппе.
Fr At 2. На внешнем энергетическом уровне у
металлов от 1 до 3-х электронов.
3. Ме0 - п е = Ме+п (окисление)
восстановитель
4. Степень окисления металла:
0, +1, +2, +3 (низшая)
+4, +5, +6, +7, +8 (высшая)
Слайд 4Изменение металлических свойств в ПСХЭ
В группах: металлические свойства усиливаются
причина: 1.увеличивается

заряд ядра,
2.число электронов на внешнем э.у не изменяется
3.радиус атома увеличивается
В периодах:
металлические свойства уменьшаются
причина: 1. увеличивается заряд ядра
2. число электронов на внешнем э.у.увеличивается
3. радиус атома уменьшается
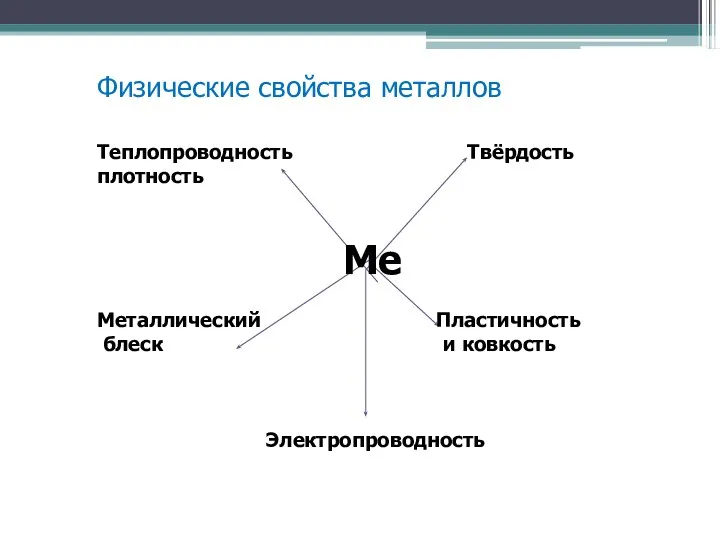
Слайд 5Физические свойства металлов
Теплопроводность Твёрдость плотность
Ме
Металлический Пластичность
блеск и ковкость
Электропроводность
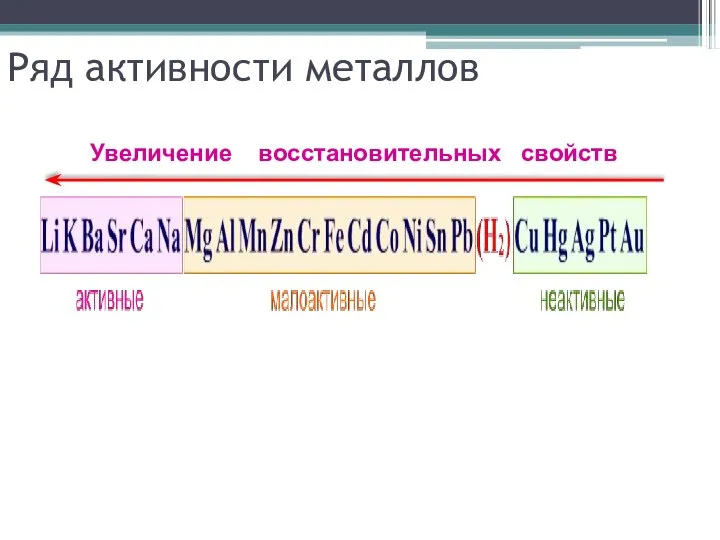
Слайд 6Ряд активности металлов
Увеличение восстановительных свойств
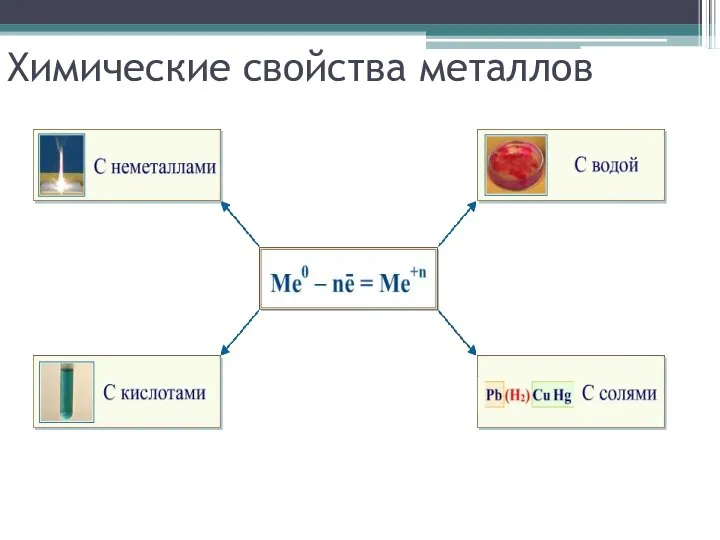
Слайд 7Химические свойства металлов
Слайд 8Химические свойства металлов
Взаимодействие с неметаллами:
с кислородом
с серой
с галогенами

Слайд 9Взаимодействие со сложными веществами:
с водой

Слайд 10Взаимодействие растворами кислот

Слайд 11Взаимодействие с растворами солей
Каждый металл вытесняет из растворов солей другие металлы, находящиеся

правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее.
Fe + CuSO4 → Cu↓ +FeSO4
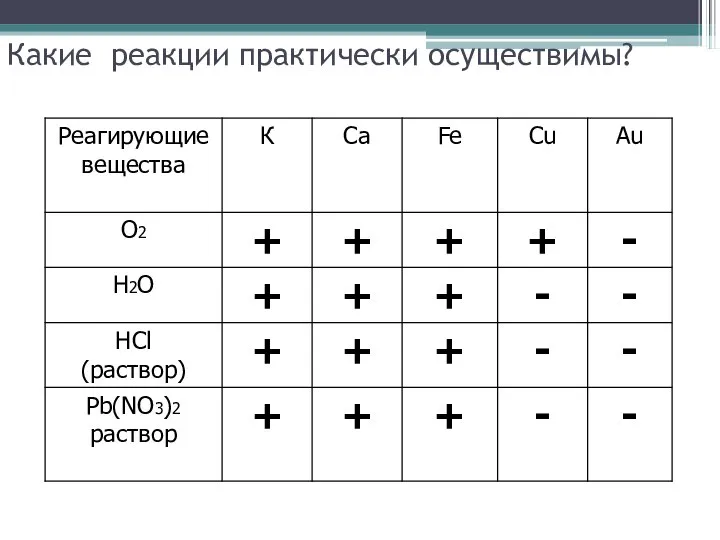
Слайд 12Какие реакции практически осуществимы?
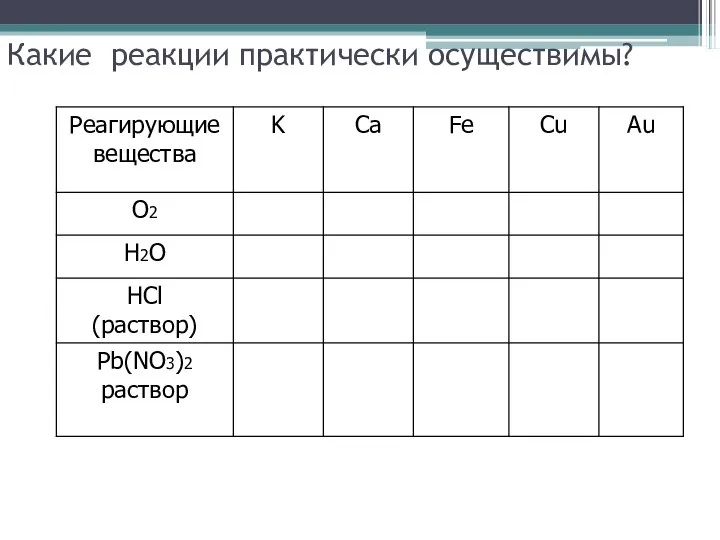
Слайд 13Какие реакции практически осуществимы?
Слайд 14Проделайте следующие опыты:
- между цинком и соляной кислотой (опустите гранулу цинка в

пробирку, прилейте 1 мл соляной кислоты, понаблюдайте за признаками реакции)
-между медью и соляной кислотой (к медной проволоке прилейте 1 мл соляной кислоты, понаблюдайте за признаками реакции) ;
- между железом и сульфатом меди (II) ( в пробирку прилейте 2 мл сульфата меди (II) и опустите в раствор железную скрепку, понаблюдайте за признаками реакции0;
- между медью и хлоридом железа (II) (в пробирку прилейте 2 мл хлорида железа ; (II) и опустите медную проволоку, понаблюдайте за признаками реакции;
- между медью и кислородом (нагрейте медь в пламени спиртовки, понаблюдайте за признаками реакции).
Слайд 151.Zn+2HCl→
2.Сu+HCl→
3.Fe+CuSO4→
4.Cu+FeCl2→
5.Cu+O2→















 Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Химия. Решение задач
Химия. Решение задач Авиационное материаловедение. Лекция №1: Введение. Теория сплавов
Авиационное материаловедение. Лекция №1: Введение. Теория сплавов Презентация на тему Бром
Презентация на тему Бром  Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Природный газ. Алканы
Природный газ. Алканы Презентация на тему История семи великих камней Алмазного фонда России
Презентация на тему История семи великих камней Алмазного фонда России  Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Основы МКТ
Основы МКТ Декоративная краска с эффектом окисленной меди
Декоративная краска с эффектом окисленной меди Техника безопасности на уроках химии
Техника безопасности на уроках химии Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Экстракционное разделение радионуклидов
Экстракционное разделение радионуклидов Кислотно-основные равновесия в растворах
Кислотно-основные равновесия в растворах Опасная бытовая химия!
Опасная бытовая химия! Типичные экспериментальные кинетические данные
Типичные экспериментальные кинетические данные Календарь юного химика. 2013-2014 учебный год
Календарь юного химика. 2013-2014 учебный год Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Металлы
Металлы Положение металлов в периодической системе Д.И. Менделеева. Физические свойства металлов
Положение металлов в периодической системе Д.И. Менделеева. Физические свойства металлов Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Презентация на тему Теория строения химических соединений А.М.Бутлерова
Презентация на тему Теория строения химических соединений А.М.Бутлерова  Количество вещества. Моль
Количество вещества. Моль Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Уравнения химических реакций
Уравнения химических реакций