Содержание
- 2. 1 8 7 4 5 6 3 2 9
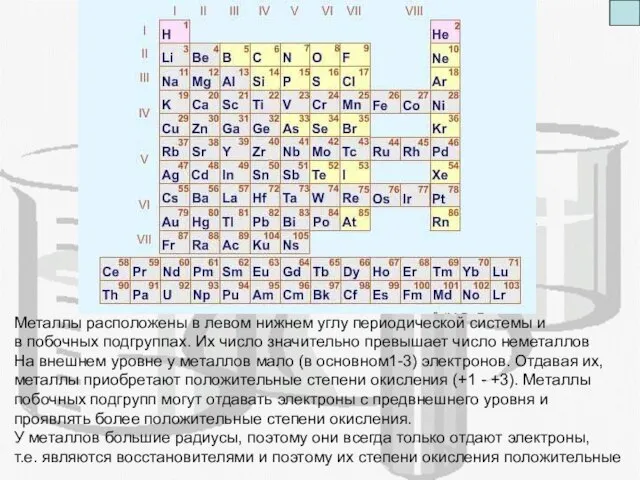
- 3. А) Каково положение металлов в периодической системе. Сколько их в сравнении с неметаллами Б) Каково число
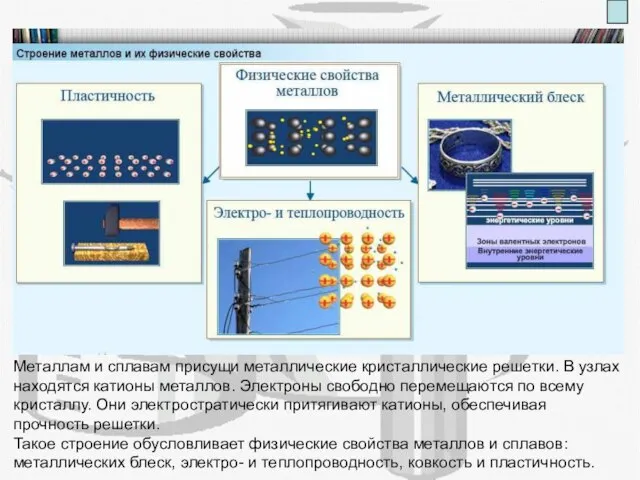
- 4. Расскажите А) Каково строение металлов-простых веществ Б) Какие физические свойства характерны для металлов Металлам и сплавам
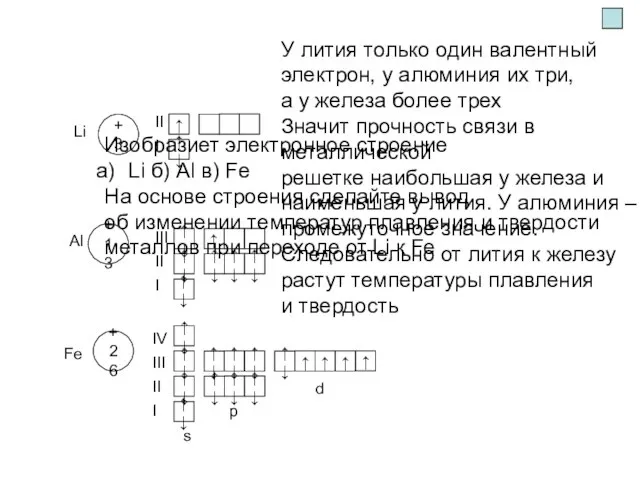
- 5. s Изобразиет электронное строение Li б) Al в) Fe На основе строения сделайте вывод об изменении
- 6. Как металлы реагируют с кислотами? Запишите взаимодействия А) Алюминия с соляной кислотой Б) Меди с соляной
- 7. Как металлы взаимодействуют с водой? Изобразите реакцию взаимодействия с водой А) Na Б) Mg
- 8. Как металлы взаимодействуют с растворами солей? Запишите реакции взаимодействия А) меди с сульфатом железа (II) Б)
- 9. В каком виде металлы различной активности содержатся в природе? Б) Запишите пример реакции получения металлов из
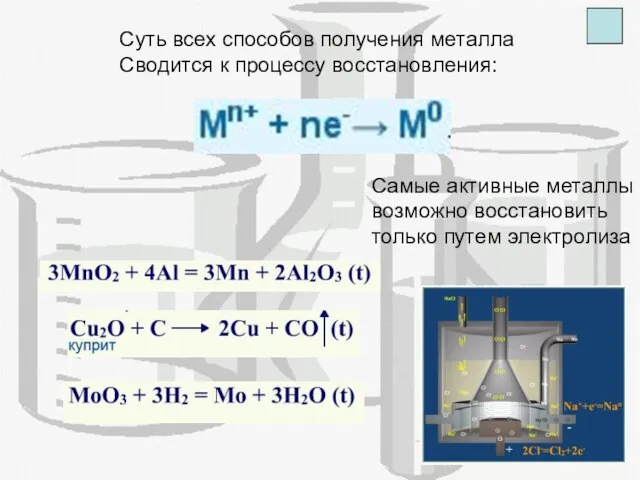
- 10. Суть всех способов получения металла Сводится к процессу восстановления: Самые активные металлы возможно восстановить только путем
- 11. Как металлы взаимодействуют с неметаллами? Приведите пример реакции.
- 12. А) Какие компоненты придают жесткость воде? Б) Как образуется накипь и как ее удалить? кипячение Жесткость
- 13. В каком случае нельзя пользоваться электрохимическим рядом напряжения металлов для сравнения их активности? Запишите возможные уравнения
- 14. Металлы, оксиды и гидроксиды которых проявляют амфотерные свойства способны взаимодействовать с едкими щелочами с образованием солей
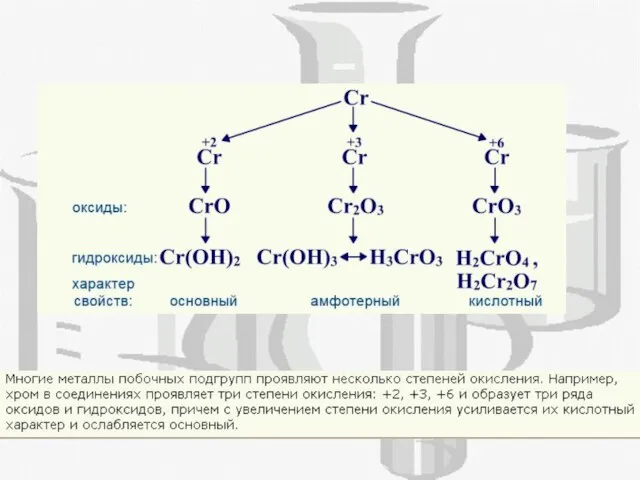
- 15. Хром способен образовывать три оксида CrO, Cr2O3, CrO3 К какому типу относятся эти оксиды и соответствующие
- 18. Скачать презентацию








 Тип кристаллической решетки у белого фосфора…. Тест
Тип кристаллической решетки у белого фосфора…. Тест Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни
Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни  Наблюдения в сходящемся свете. Коноскопия
Наблюдения в сходящемся свете. Коноскопия Современные способы защиты ОТТ
Современные способы защиты ОТТ Кремний – химический элемент или природный дар
Кремний – химический элемент или природный дар Калийные удобрения
Калийные удобрения Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13
Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13 Соли. Состав и классификация
Соли. Состав и классификация Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Химия элементов IVA группы
Химия элементов IVA группы получение Ме презентация
получение Ме презентация Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Химические структуры
Химические структуры Контрольная работа
Контрольная работа Химическое равновесие
Химическое равновесие Презентация на тему Алканолы - Предельные одноатомные спирты
Презентация на тему Алканолы - Предельные одноатомные спирты  Химия. Вещества. 8 класс
Химия. Вещества. 8 класс Химическая связь
Химическая связь Презентация на тему: Подгруппа азота
Презентация на тему: Подгруппа азота Непредельные углеводороды: алкены и алкины
Непредельные углеводороды: алкены и алкины Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Хлороводород и соляная кислота
Хлороводород и соляная кислота Относительная молекулярная масса вещества
Относительная молекулярная масса вещества lektsia_5
lektsia_5 Мыло. Интересно об известном
Мыло. Интересно об известном