Содержание
- 2. Фосфины. Гомологические ряды Идентифицировано и описано около 85 фосфинов Существует как минимум 11 гомологических рядов: PnHn+2
- 3. Фосфин. Получение Гидролиз и алкоголиз фосфидов металлов (например, AlP, Ca3P4 (побочный продукт – P2H4)) Пиролиз фосфористой
- 4. Фосфин. Физические свойства Бесцветный ядовитый газ со специфическим запахом, напоминающим запах гнилой рыбы (чувствуется при концентрации
- 5. Фосфин. Химические свойства Раствор фосфина в воде – амфотерное соединение Самовоспламеняется на воздухе Сильный восстановитель Фосфин
- 6. Дифосфин (P2H4) При н. у. – бесцветная легколетучая жидкость, легко разлагается (ΔfH° ~21 кдж/моль) Оценочная температура
- 7. Продукты разложения дифосфина (E. Fluck, 1973)
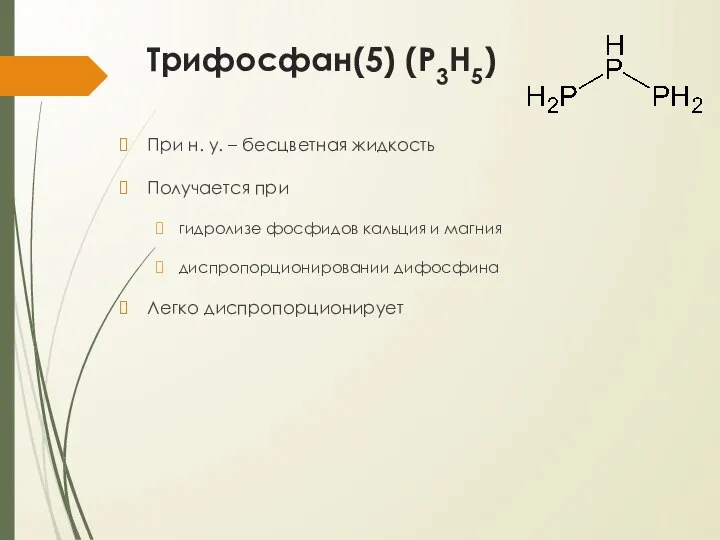
- 8. Трифосфан(5) (P3H5) При н. у. – бесцветная жидкость Получается при гидролизе фосфидов кальция и магния диспропорционировании
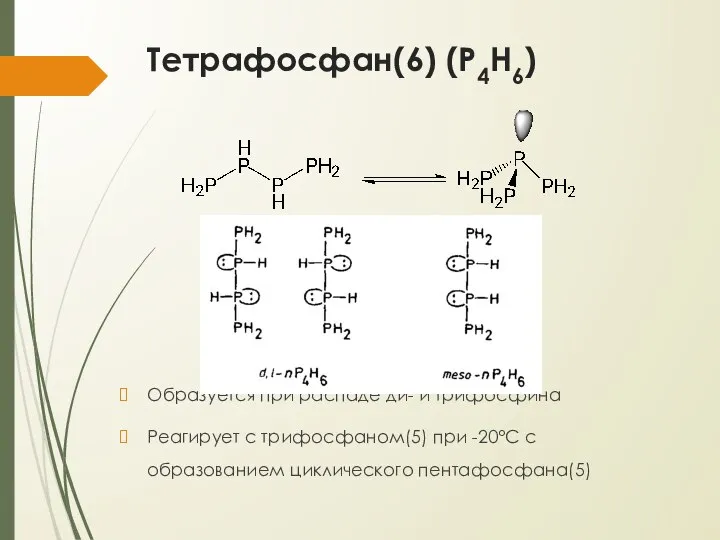
- 9. Тетрафосфан(6) (P4H6) Образуется при распаде ди- и трифосфина Реагирует с трифосфаном(5) при -20°С с образованием циклического
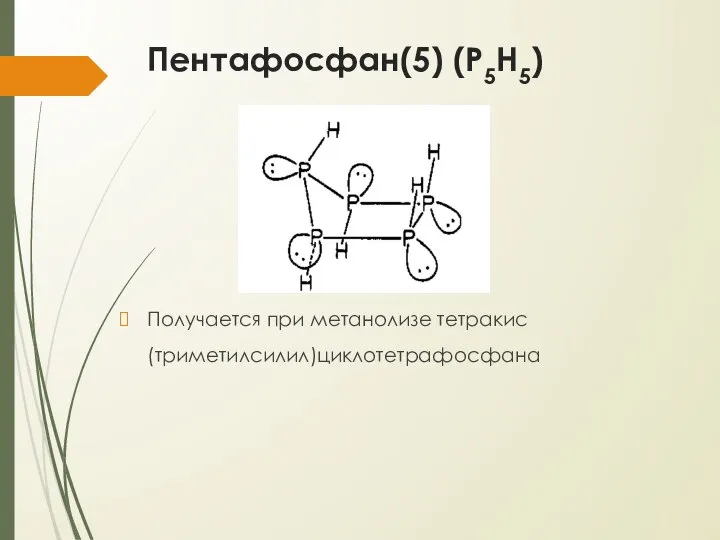
- 10. Пентафосфан(5) (P5H5) Получается при метанолизе тетракис(триметилсилил)циклотетрафосфана
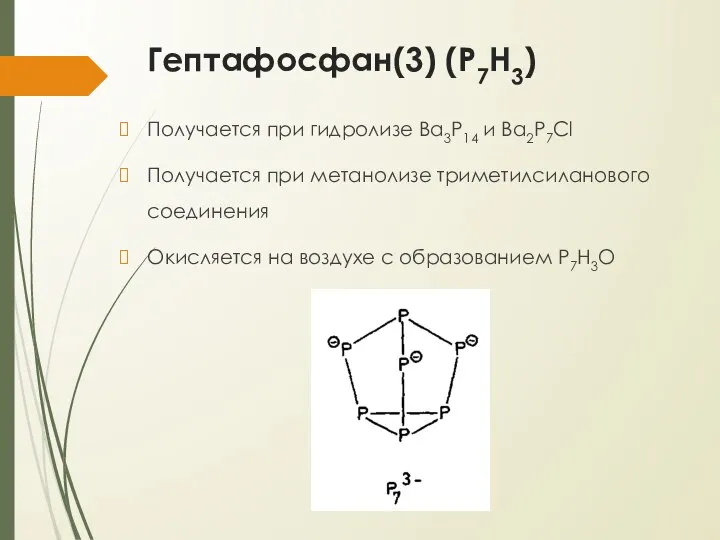
- 11. Гептафосфан(3) (P7H3) Получается при гидролизе Ba3P14 и Ba2P7Cl Получается при метанолизе триметилсиланового соединения Окисляется на воздухе
- 12. Галогениды фосфора Фосфор образует 3 ряда галогенидов – P2X4, PX3 и PX5 Все 12 существуют (PI5?)
- 13. Галогениды фосфора
- 14. Тригалогениды фосфора Летучие и химически активные Получают косвенным путем и прямым синтезом Гидролизуются водой с образованием
- 16. Тетрагалогениды фосфора Получают из смешанных галогенидов … тригалогенидов … прямым синтезом
- 17. Пентагалогениды фосфора PF5 имеет молекулярное строение PCl5 в газовой фазе имеет молекулярное строение, в твердой фазе
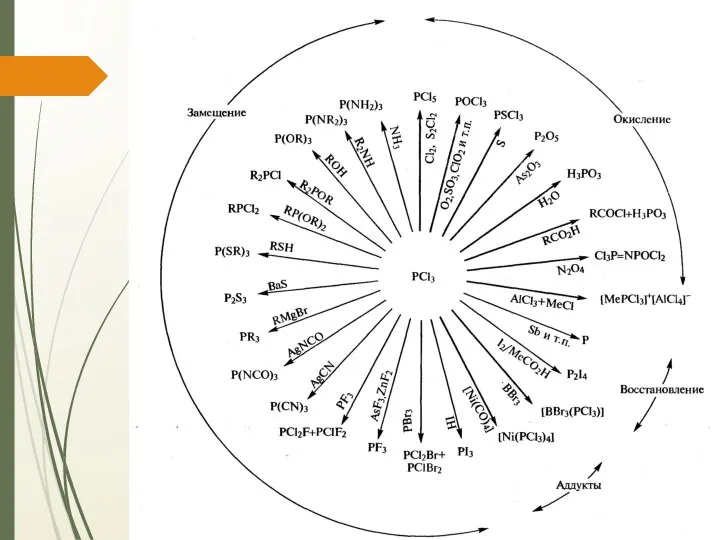
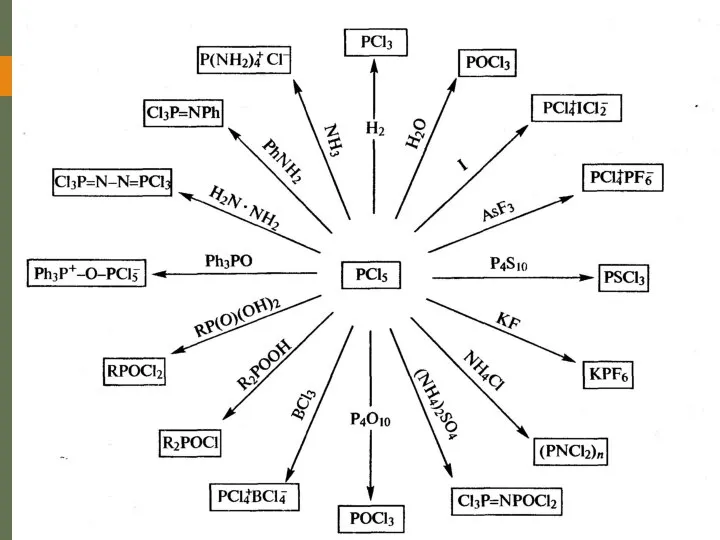
- 18. Пентагалогениды фосфора. Получение Замещение атомов галогенов Прямой синтез в избытке галогена Реакция галогена с тригалогенидом
- 19. Пентагалогениды фосфора
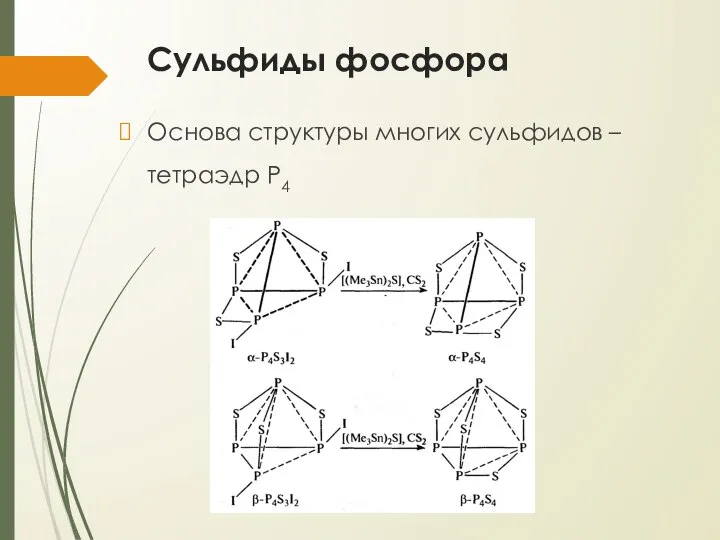
- 20. Сульфиды фосфора Основа структуры многих сульфидов – тетраэдр P4
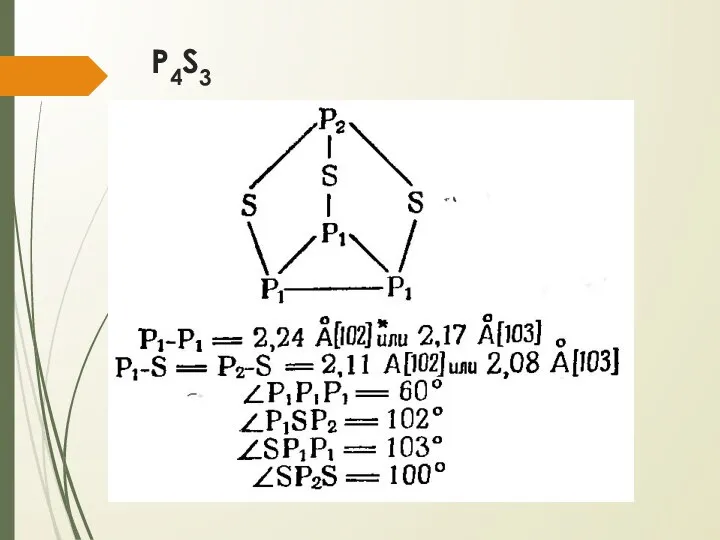
- 21. P4S3 Самый устойчивый сульфид Получается при нагревании серы с красным фосфором при t > 180°C в
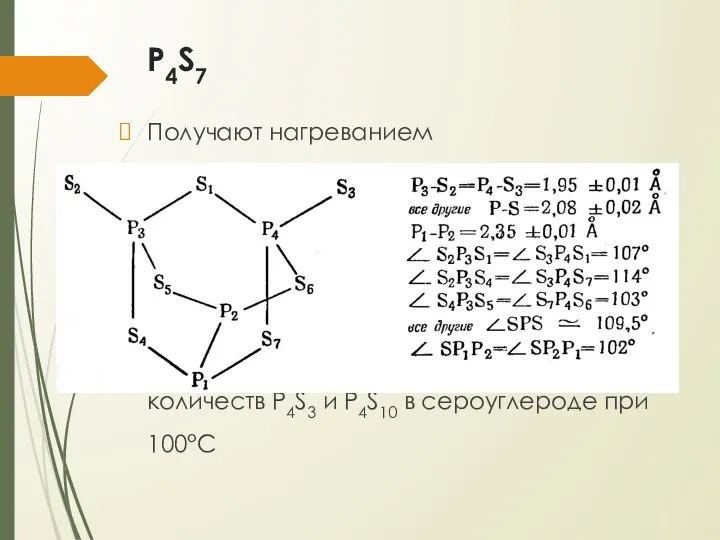
- 22. P4S7 Получают нагреванием стехиометрических количество фосфора и серы в присутствии 5% P4S3 в трубке из тугоплавкого
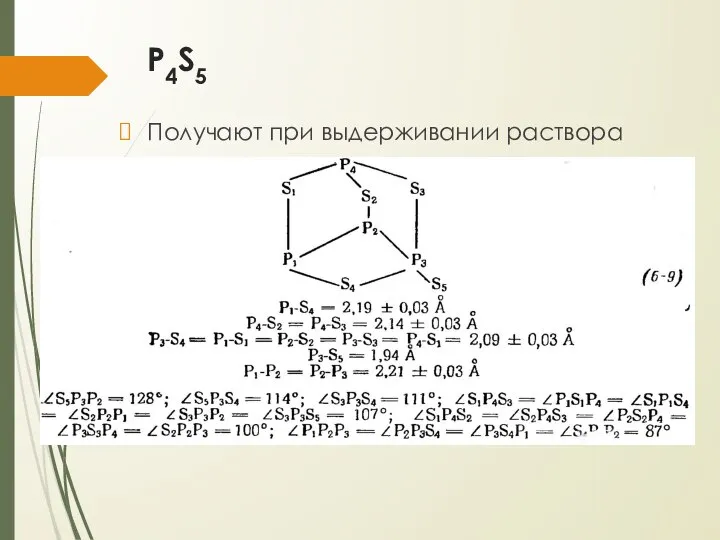
- 23. P4S5 Получают при выдерживании раствора стехиометрических количеств P4S3 и серы со следами иода на рассеянном дневном
- 24. Фосфорные кислоты
- 25. Фосфорные кислоты с двумя и более атомами Р Дифосфористая (пирофосфористая) H4P2O5 Фосфорноватая (гипофосфорная) H4P2O6 Дифосфорная (пирофосфорная)
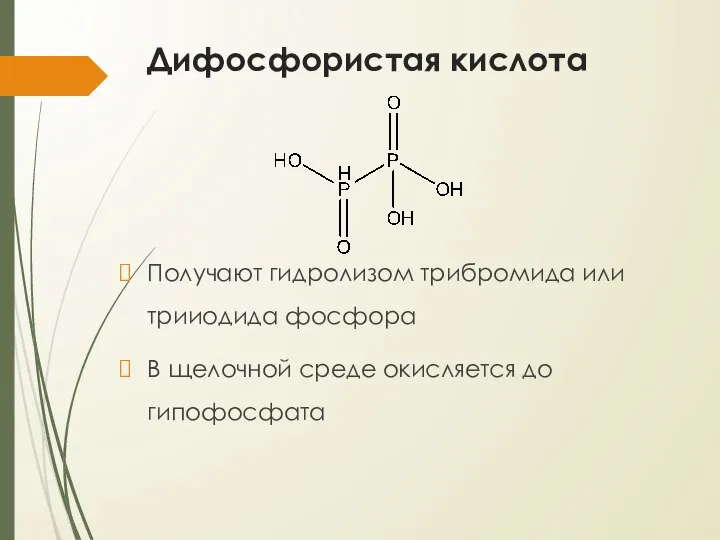
- 26. Дифосфористая кислота Получают гидролизом трибромида или трииодида фосфора В щелочной среде окисляется до гипофосфата
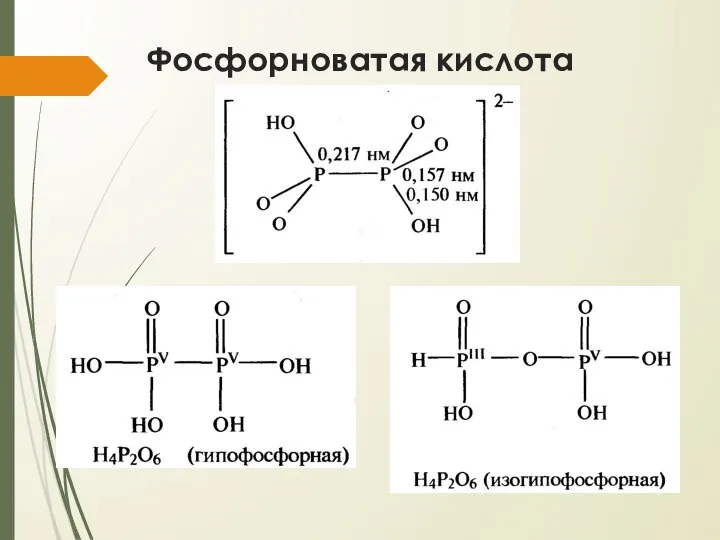
- 27. Фосфорноватая кислота
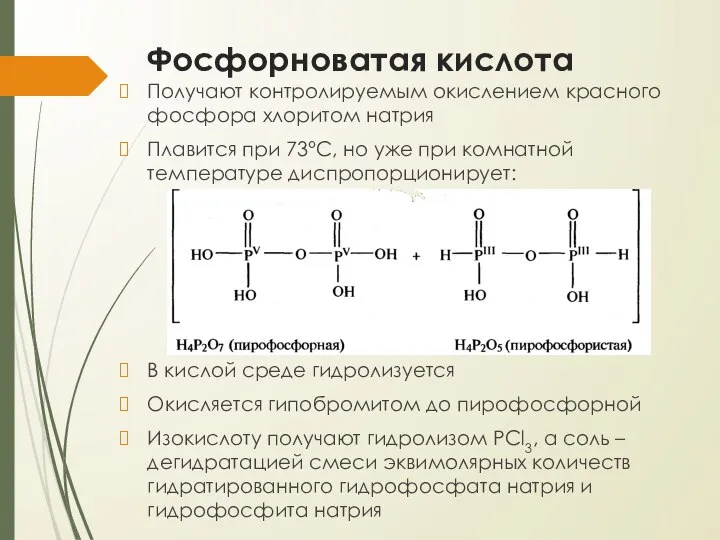
- 28. Фосфорноватая кислота Получают контролируемым окислением красного фосфора хлоритом натрия Плавится при 73°С, но уже при комнатной
- 30. Скачать презентацию














 Оксиды. Классификация, химические и физические свойства
Оксиды. Классификация, химические и физические свойства Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия Презентация на тему Гидролиз
Презентация на тему Гидролиз  Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Органические вещества. 9 класс
Органические вещества. 9 класс Гибридизация АО. Пространственное строение молекул (геометрия молекул)
Гибридизация АО. Пространственное строение молекул (геометрия молекул) Приемы разделения мембранных липидов на классы
Приемы разделения мембранных липидов на классы Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Изомерия. Виды изомерии
Изомерия. Виды изомерии Классы неорганических веществ. Типы химических реакций Конкурс знаний
Классы неорганических веществ. Типы химических реакций Конкурс знаний Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Неорганические вещества
Неорганические вещества Методы диагностики плазмы
Методы диагностики плазмы Практическая работа: наблюдение роста кристалов
Практическая работа: наблюдение роста кристалов Реакции разложения и соединения
Реакции разложения и соединения Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Агрегатные состояния вещества
Агрегатные состояния вещества Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс
Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях Химия в быту
Химия в быту АЛЬДЕГИДЫ И КЕТОНЫ
АЛЬДЕГИДЫ И КЕТОНЫ _ _Производство цветных металлов. Методы плавки алюминия_
_ _Производство цветных металлов. Методы плавки алюминия_ Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии