Содержание
- 2. Реакцию, уравнение которой N2(г) + 3Н2(г) ⮀ 2NН3(г) + Q относят к реакциям: 1) обратимым, экзотермическим
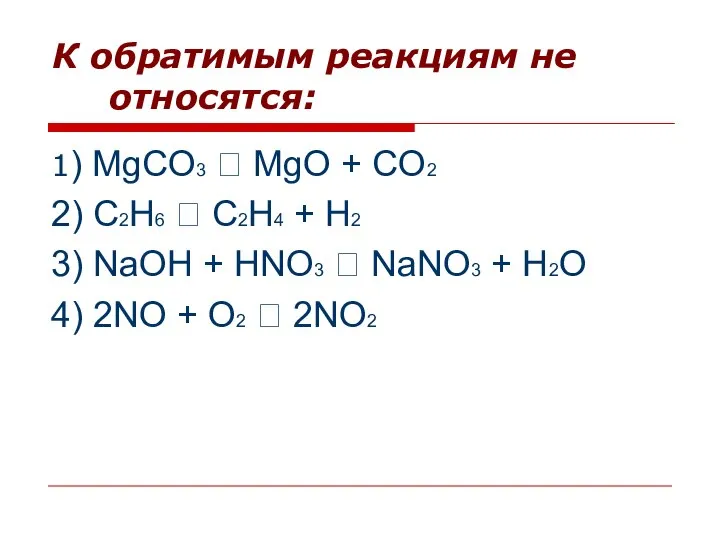
- 3. К обратимым реакциям не относятся: 1) MgCO3 ⭢ MgO + CO2 2) C2H6 ⭢ C2H4 +
- 4. К реакциям замещения относится взаимодействие: 1) метана и кислорода 2) брома и водорода 3) бутана и
- 5. Простое вещество может быть получено в реакциях 1) соединения и замещения 2) замещения и разложения 3)
- 6. Окислительно-восстановительная реакция соединения протекает между: 1) хлороводородом и аммиаком 2) аммиаком и кислородом 3) кислородом и
- 7. Скорость химической реакции горения угля в кислороде уменьшится при: 1) увеличении концентрации кислорода 2) повышении температуры
- 8. С наибольшей скоростью при комнатной температуре протекает реакция: 1) Zn и HCl(1%ный р-р) 2) Zn и
- 9. Скорость прямой реакции в системе: 2SO2 + O2 ⮀ 2SO3 + Q при увеличении давления в
- 10. Скорость реакции при повышении температуры на 40°С и температурном коэффициенте реакции, равном 2, увеличится в: 1)
- 11. Химическое равновесие сместится вправо при увеличении давления в системе: 1) H2 + Cl2 ⮀ 2HCl 2)
- 12. Химическое равновесие в системе С3Н8 ⮀ С3Н6 + Н2 – Q можно сместить в сторону продуктов
- 13. В соответствии с термохимическим уравнением 3Fe3O4+8Al=9Fe+4Al2O3+ 3330кДж при образовании 2 моль оксида алюминия: 1) выделяется 1655
- 14. Укажите все возможные способы смещения химического равновесия в сторону прямой реакции: NH3(г) + H2S(г) ⮀ NH4HS(тв)
- 15. Химическое равновесие в системе: N2(г) + 3Н2(г) ⮀ 2NН3(г) установилось при равновесных концентрациях: [NН3] = 0,4моль/л,
- 17. Скачать презентацию













 Оксиды
Оксиды Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Электролитическая диссоциация
Электролитическая диссоциация Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР диовые кислоты
диовые кислоты Презентация на тему Викторина по химии "Что это?"
Презентация на тему Викторина по химии "Что это?"  Магматические породы
Магматические породы Соли
Соли Углеводы
Углеводы Гальванические элементы
Гальванические элементы Кислоты. Начальные сведения
Кислоты. Начальные сведения Презентация на тему Хлороводород. Соляная кислота
Презентация на тему Хлороводород. Соляная кислота  Кристаллы
Кристаллы Строение воды
Строение воды Значение химии в медицине
Значение химии в медицине Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Химия элементов (лекция 4)
Химия элементов (лекция 4) Соляная кислота и её соли
Соляная кислота и её соли Адсорбция на границе раствор-газ. ПАВ и ПНАВ
Адсорбция на границе раствор-газ. ПАВ и ПНАВ Кремневая кислота и ее соли
Кремневая кислота и ее соли Состав атома
Состав атома Химическая кинетика. Факторы, влияющие на скорость реакции
Химическая кинетика. Факторы, влияющие на скорость реакции Образование химических связей
Образование химических связей Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Азотная кислота
Азотная кислота Изомерия алкенов
Изомерия алкенов Пятая группа элементов
Пятая группа элементов Определение содержания солей в воде
Определение содержания солей в воде