Содержание
- 2. Алканы. Химические свойства Алканы – малополярные и слабополяризуемые соединения Гетеролитический (а) и гомолитический (б) разрыв связей
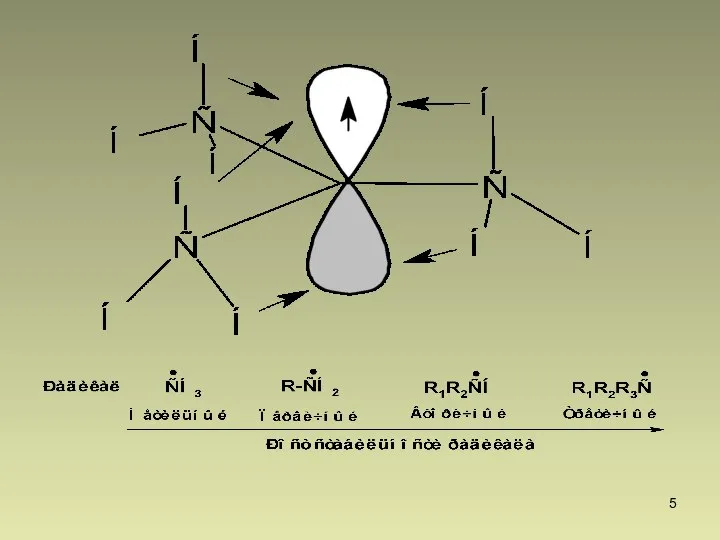
- 3. Свободными радикалами называются частицы, имеющие один или несколько неспаренных электронов. Наибольшее значение в органической химии имеют
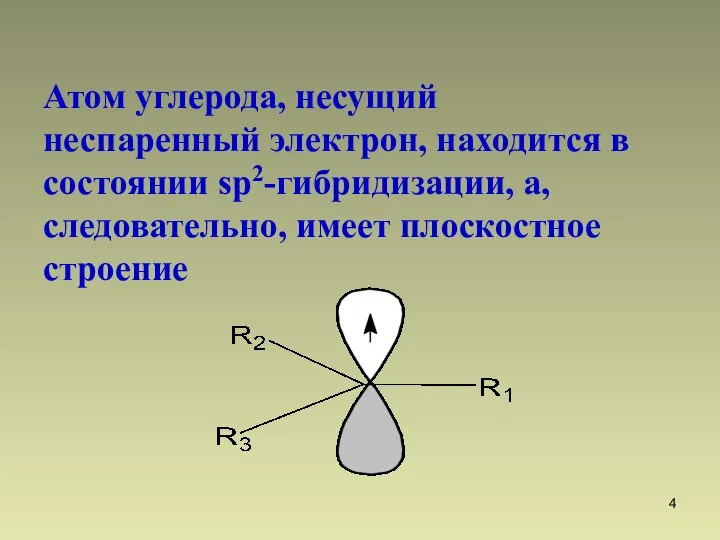
- 4. Атом углерода, несущий неспаренный электрон, находится в состоянии sp2-гибридизации, а, следовательно, имеет плоскостное строение
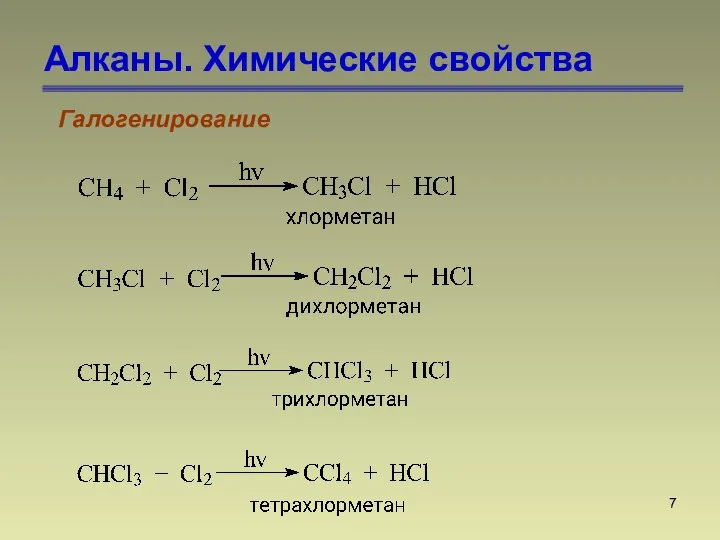
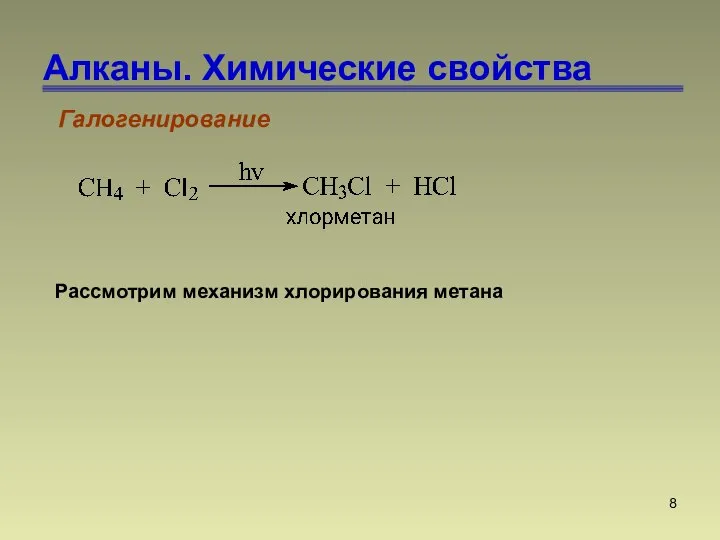
- 7. Алканы. Химические свойства Галогенирование
- 8. Алканы. Химические свойства Рассмотрим механизм хлорирования метана Галогенирование
- 9. Алканы. Химические свойства Галогенирование (Механизм реакции) Инициирование
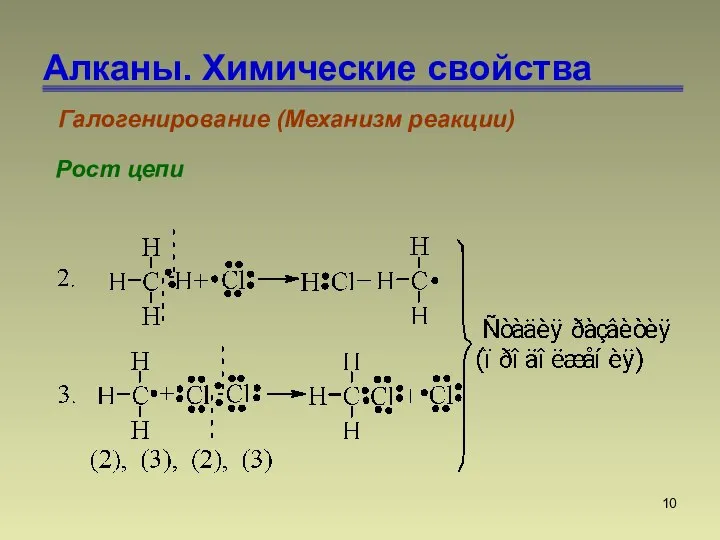
- 10. Алканы. Химические свойства Галогенирование (Механизм реакции) Рост цепи
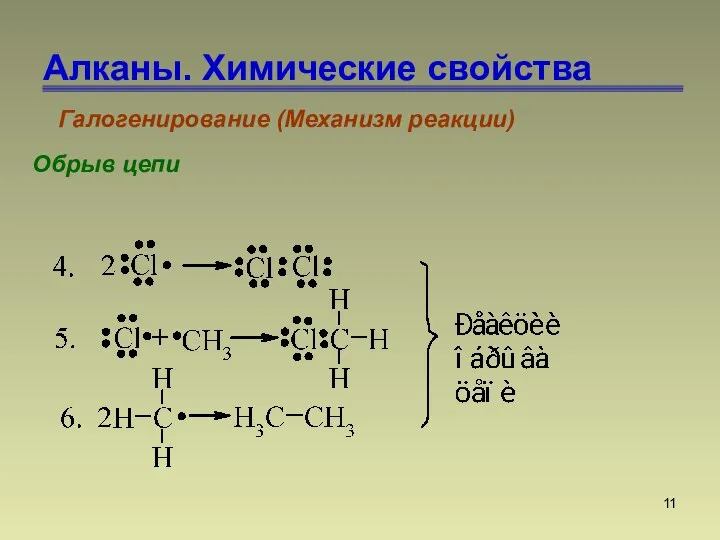
- 11. Алканы. Химические свойства Галогенирование (Механизм реакции) Обрыв цепи
- 12. Алканы. Химические свойства Галогенирование (Механизм реакции) Скорость цепной реакции сильно снижается в присутствии соединений, которые взаимодействуют
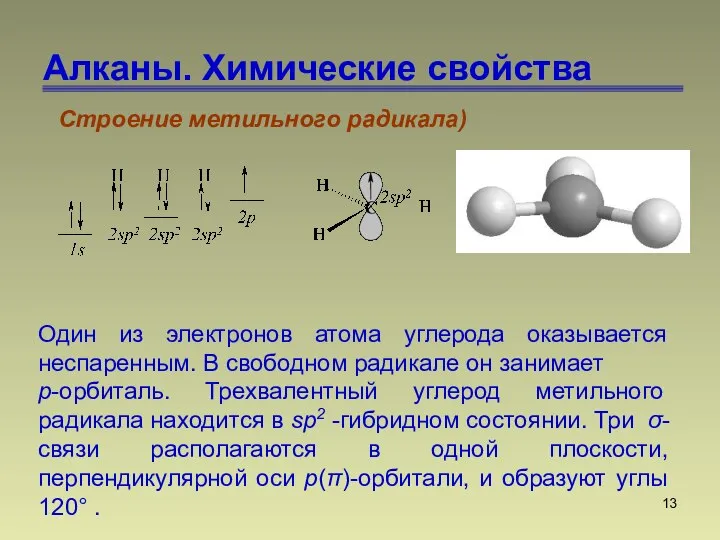
- 13. Алканы. Химические свойства Строение метильного радикала) Один из электронов атома углерода оказывается неспаренным. В свободном радикале
- 14. Алканы. Химические свойства Галогенирование (Механизм реакции) 1.Галогенирование начинается только под действием инициатора радикальных реакций (УФ-свет, радикальные
- 15. Алканы. Химические свойства Галогенирование (Механизм реакции) Изменение энергии в ходе реакции Реакция хлорирования метана Реакция бромирования
- 16. Алканы. Химические свойства Галогенирование (Механизм реакции SR ) Реакция хлорирования – обе стадии экзотермичны, бромирование –
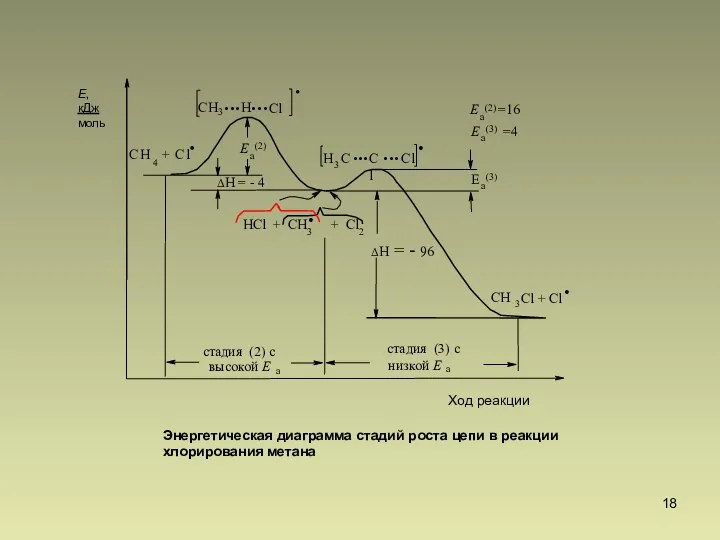
- 17. Алканы. Химические свойства Энергетическая диаграмма реакции. Связь энергии активации с экзотермичностью.
- 18. . C H 4 + C l . E a (2) H . . 3 Cl
- 19. Алканы. Химические свойства Галогенирование (Механизм реакции SR ) В свободнорадикальных процессах, протекающих без участия заряженных частиц,
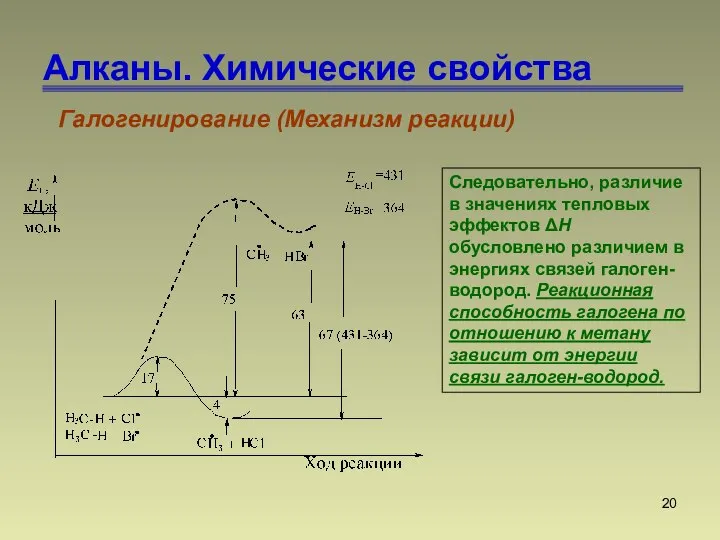
- 20. Алканы. Химические свойства Галогенирование (Механизм реакции) Следовательно, различие в значениях тепловых эффектов ΔН обусловлено различием в
- 21. Алканы. Химические свойства Галогенирование Зависимость реакционной способности галогенов от энергии связи H–Hal
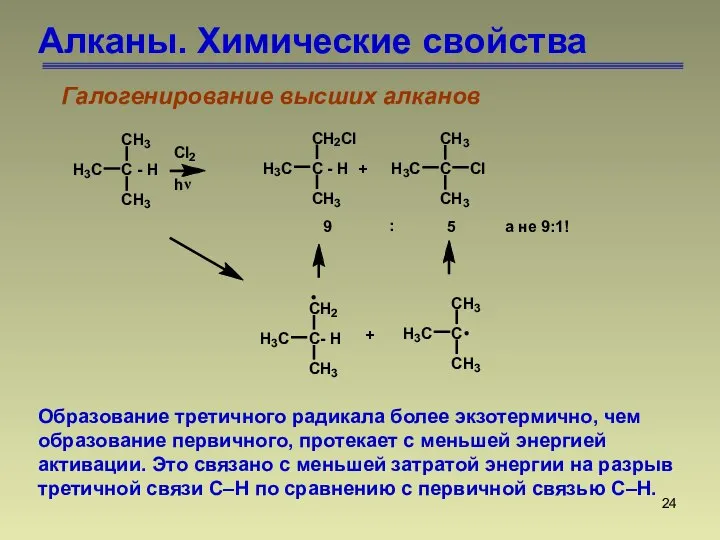
- 22. Алканы. Химические свойства Галогенирование высших алканов Хлорирование изо-бутана Бромирование изо-бутана
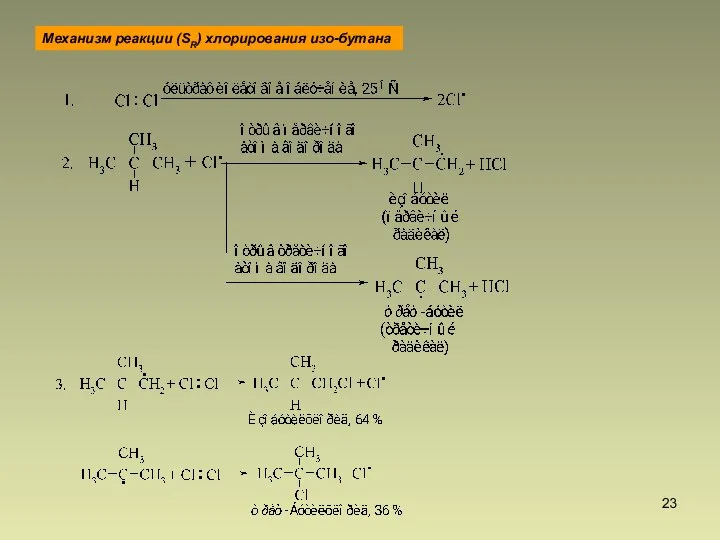
- 23. Механизм реакции (SR) хлорирования изо-бутана
- 24. Алканы. Химические свойства Галогенирование высших алканов Образование третичного радикала более экзотермично, чем образование первичного, протекает с
- 25. Алканы. Химические свойства Галогенирование высших алканов Ряд легкости образования радикалов: третичный > вторичный > первичный >
- 26. Энергии разрыва связей С–Н в алканах Алканы. Химические свойства
- 27. Алканы. Химические свойства Галогенирование высших алканов Ряд устойчивости радикалов: третичный > вторичный > первичный > СН3∙.
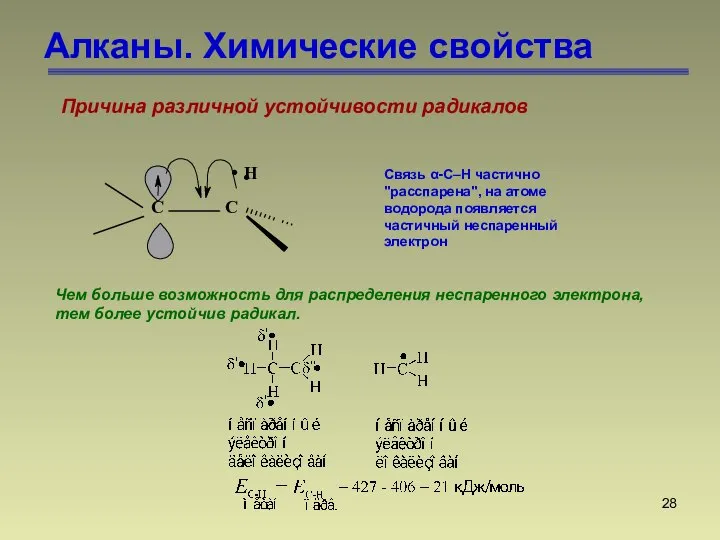
- 28. Алканы. Химические свойства Причина различной устойчивости радикалов Связь α-C–H частично "расспарена", на атоме водорода появляется частичный
- 29. Алканы. Химические свойства Галогенирование высших алканов Во всех случаях, когда в молекуле присутствует «нештатное» количество электронов:
- 30. Алканы. Химические свойства Селективность в реакциях хлорирования и бромирования Энергия активации медленной стадии реакции (SR) RH
- 31. Алканы. Химические свойства Реакционная способность первичной, вторичной, третичной связей С–Н в алканах: в реакции хлорирования 1:
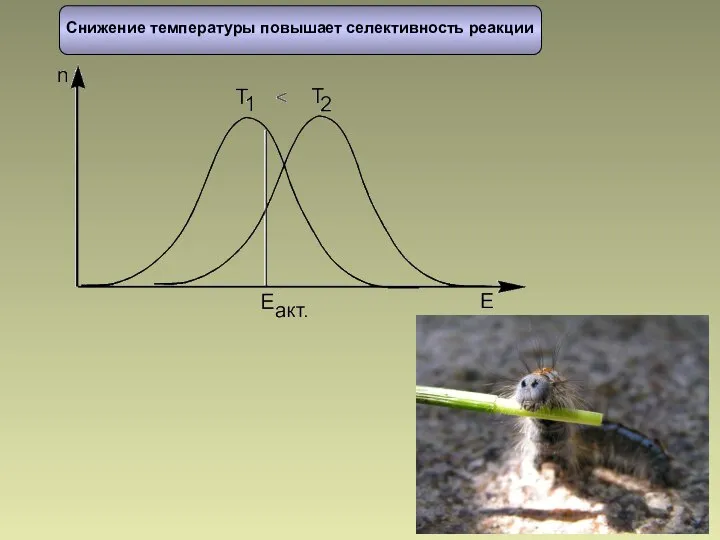
- 33. Снижение температуры повышает селективность реакции
- 34. Пример расчета состава продуктов хлорирования н-бутана. Общая активность шести первичных связей С–Н молекулы бутана равна 6
- 35. Алканы. Химические свойства Сульфохлорирование С10H22 + SO2 + Cl2 → C10H21SO2Cl + HCl декан сульфохлорид декана
- 36. Алканы. Химические свойства Сульфоокисление В реакциях сульфоокисления и сульфохлорирования замещению не подвергаются атомы водорода при третичном
- 37. Алканы. Химические свойства Нитрование Реакция М.И. Коновалова Жидкофазное нитрование: 10-20%-ная HNO3, 150 ОС (М.И.Коновалов, 1888г.) Парофазное
- 38. Алканы. Химические свойства Коновалов Михаил Иванович 1858 - 1906
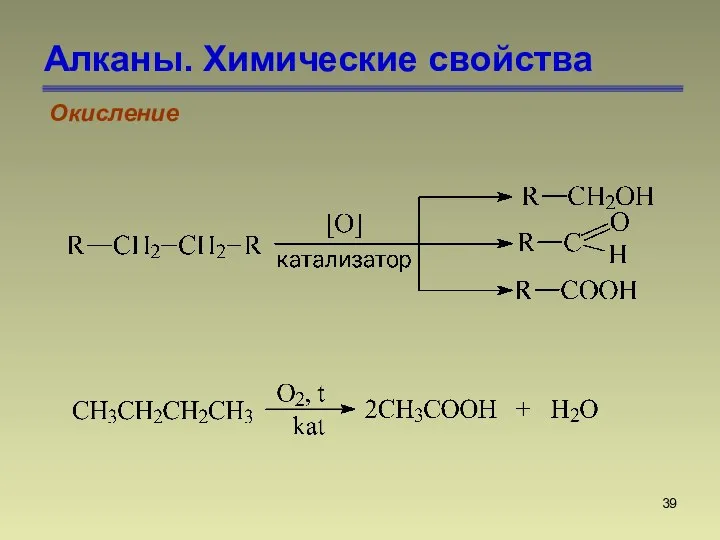
- 39. Алканы. Химические свойства Окисление
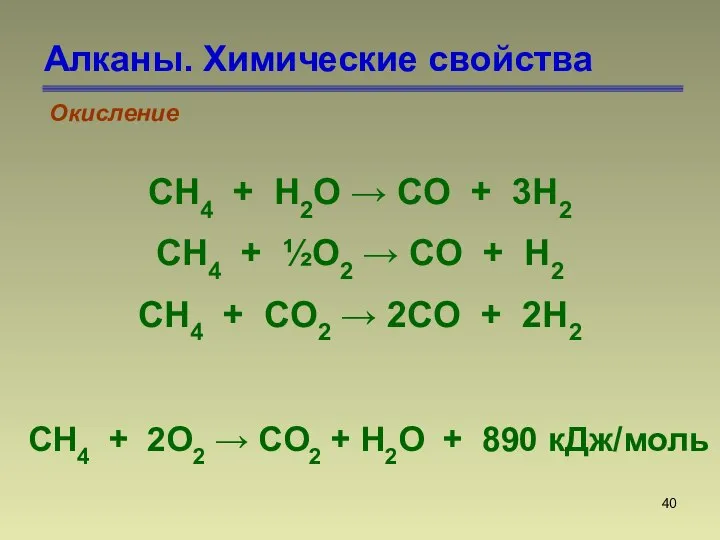
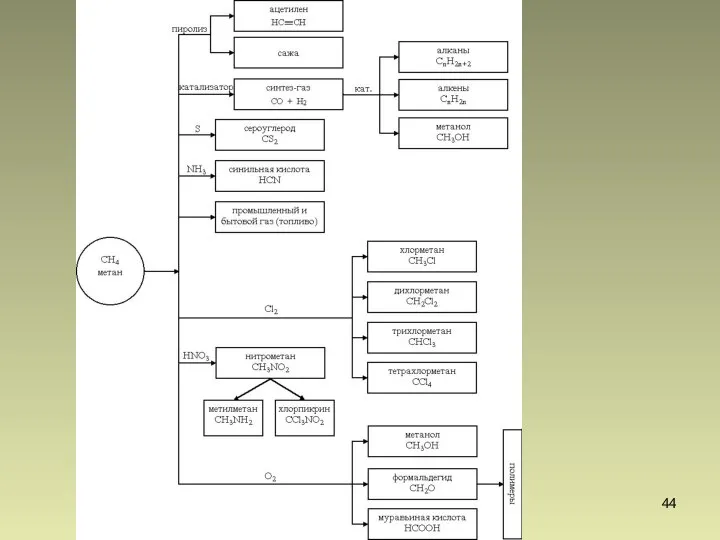
- 40. Алканы. Химические свойства Окисление CH4 + H2O → CO + 3H2 CH4 + ½O2 → CO
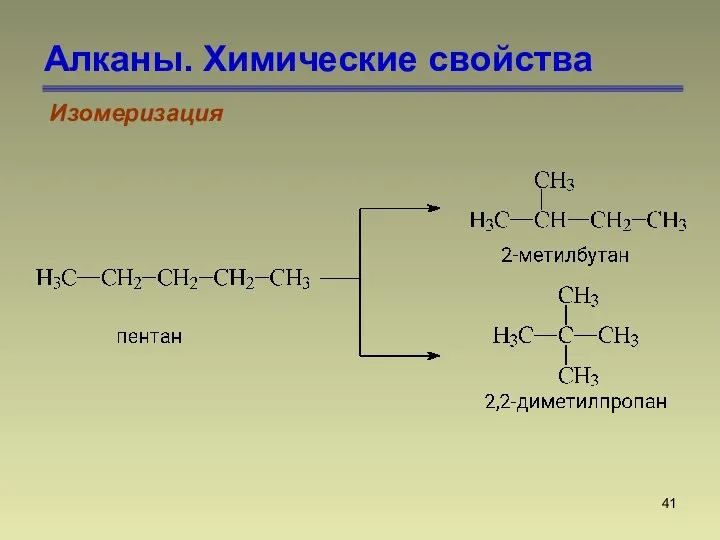
- 41. Алканы. Химические свойства Изомеризация
- 42. Алканы. Химические свойства Термическое разложение (Крекинг) В.Г. Шухов (1891) Температура – 470—650°С; Давление – 7 МПа
- 43. Алканы. Химические свойства Каталитический крекинг Катализаторы – АlСl3, Сr2О3, алюмосиликаты; Температура – 470—500°С; Давление 0,01—0,1 МПа
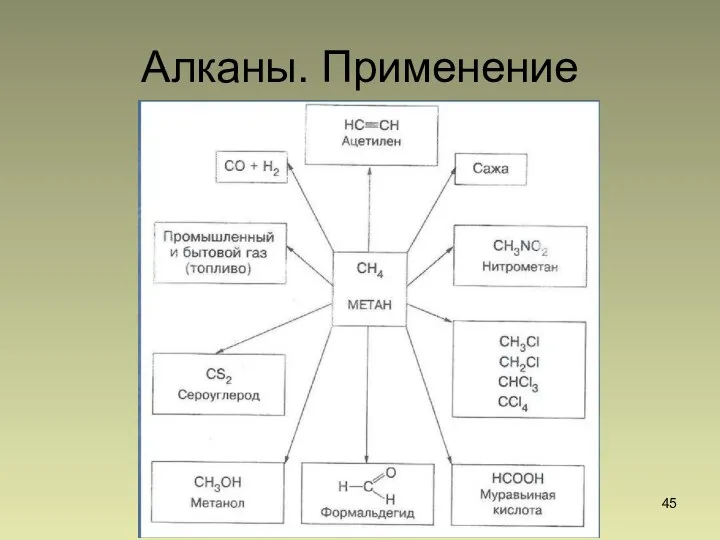
- 45. Алканы. Применение
- 55. Скачать презентацию
































 Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Растворимость веществ. Кристаллогидраты
Растворимость веществ. Кристаллогидраты Комплексное задание по дисциплине основы материаловедения для группы 18
Комплексное задание по дисциплине основы материаловедения для группы 18 Полимеры. Функции полимеров
Полимеры. Функции полимеров Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева
Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева Периодический закон. Периодическая таблица химических элементов. 8 класс
Периодический закон. Периодическая таблица химических элементов. 8 класс Основания. Получение оснований
Основания. Получение оснований Щелочные металлы
Щелочные металлы Периодический закон и Периодическая система химических элементов Д. И. Менделеева
Периодический закон и Периодическая система химических элементов Д. И. Менделеева Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа lektsia_7
lektsia_7 Кристаллы
Кристаллы Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Изготовление искусственного янтаря
Изготовление искусственного янтаря Вспоминаем химию
Вспоминаем химию Химическое ассорти
Химическое ассорти Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Железо
Железо Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Соединения серы
Соединения серы Химия в моей специальности
Химия в моей специальности Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Презентация на тему Поверхностно-активные вещества
Презентация на тему Поверхностно-активные вещества  Амины
Амины Присоединение аммиака и аминов
Присоединение аммиака и аминов Щелочные металлы
Щелочные металлы Опыты с хондроитин сульфатом
Опыты с хондроитин сульфатом Тестовые задания. Атомы
Тестовые задания. Атомы