Содержание
- 2. ПЛАН Окислительно-восстановительная реакция (ОВР). Сопряженная окислительно-восстановительная пара. Типы ОВР. Направление ОВР. Red-ox потенциал; факторы, влияющие на
- 3. Окислительно-восстановительные реакции (ОВР)… …химические реакции, протекающие с изменением степени окисления атомов (СО) вследствие перераспределения электронов между
- 4. Сопряжённая окислительно-восстановительная пара Любую ОВР можно представить как единство двух противоположных превращений – окисления и восстановления
- 5. Направление ОВР В ОВР имеет место конкуренция за ē между окислителями, что может быть выражено схемой:
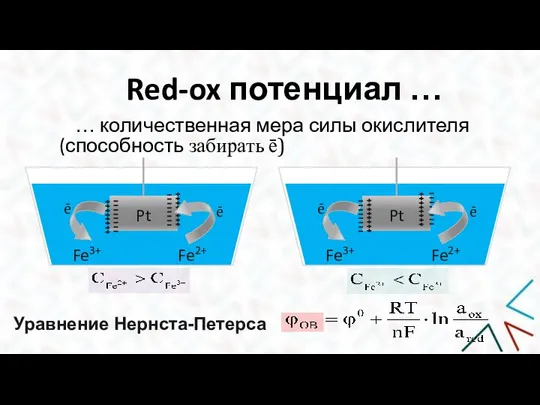
- 6. Red-ox потенциал … … количественная мера силы окислителя (способность забирать ē) Pt Fe3+ Fe2+ ē ē
- 7. Факторы, влияющие на величину Red-ox потенциала Red-ox потенциал характеризует сопряжённую ОВ пару. ? Чем больше величина
- 8. Лигандное окружение… … необходимо учитывать в биологическом ОВП. Возможны 2 варианта: лиганд образует более прочный комплекс
- 9. Связь Red-ox потенциалов с термодинамическими характеристиками ОВР Исходные формулы: Модифицированные формулы
- 10. Принцип Шеффера ? С большей скоростью, как правило, протекают те реакции, в ходе которых окислитель и
- 11. Особенности ОВР в организме Для характеристики свойств природных ОВ пар вместо ϕ° используют величины формальных (mid-point)
- 12. Особенности ОВР в организме При биоокислении органических соединений меняется только степень окисления атома углерода. Реакции биоокисления−восстановления
- 13. Особенности ОВР в организме Степень окисления любого атома углерода равна Σ числа всех его связей с
- 14. − Типы биологических ОВР Внутримолекулярная дисмутация возможна при наличии в молекуле субстрата атомов углерода с различными
- 15. Типы биологических ОВР Вывод: ферменты, под действием которых происходят разобранные ОВР реакции в передаче и приёме
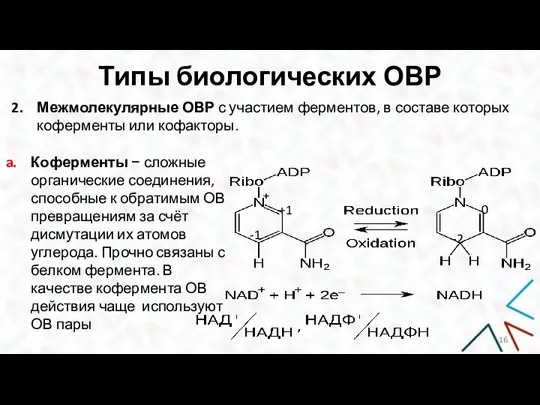
- 16. Типы биологических ОВР Межмолекулярные ОВР с участием ферментов, в составе которых коферменты или кофакторы. Коферменты −
- 17. Типы биологических ОВР ОВР с участием НАД+ описывается уравнением: ОВ свойства коферментов в организме зависят от
- 18. Витамин РР Витамин РР участвует в синтезе НАД+ и при его недостатке возникает заболевание Pellagra. Суточная
- 19. Электроннотранспортная цепь (ЭТЦ) митохондрий ЭТЦ − пример действия ферментов с кофакторами. Фермент в этом случае является
- 20. Электроннотранспортная цепь (ЭТЦ) митохондрий Cyt (Fe3+) + ē ↔ Cyt (Fe2+) В митохондрии идёт реакция: ½О2
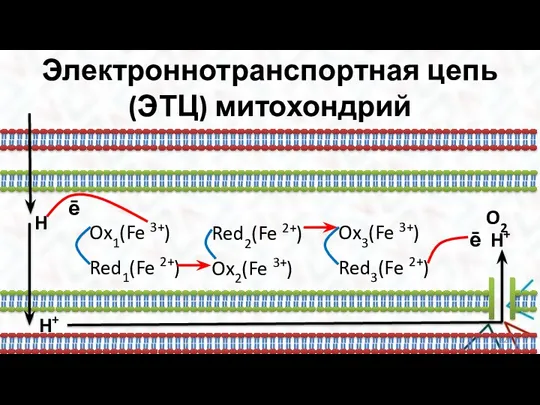
- 21. Электроннотранспортная цепь (ЭТЦ) митохондрий Перенос ē осуществляется вдоль membrana interna митохондрии, а перенос протонов − из
- 22. Электроннотранспортная цепь (ЭТЦ) митохондрий H ē Ox1(Fe 3+) Red1(Fe 2+) Ox2(Fe 3+) Red2(Fe 2+) Ox3(Fe 3+)
- 23. Электроннотранспортная цепь (ЭТЦ) митохондрий Н Н+ ē Ox1 (Fe3+) Red1 (Fe2+) ē Ox2 Red2 ē Ox3
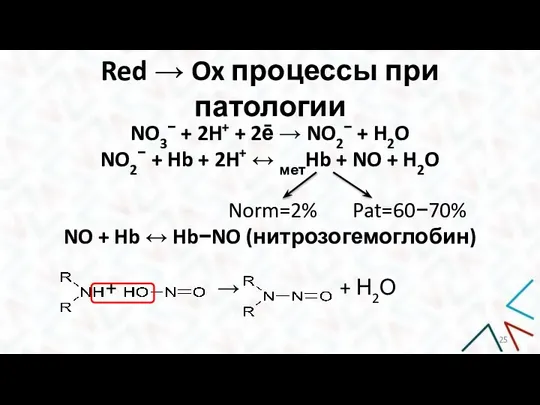
- 24. Red → Ox процессы при патологии Патологические Red→Ox процессы вызваны попаданием в организм сильных окислителей: перманганатов,
- 25. Red → Ox процессы при патологии NO3− + 2H+ + 2ē → NO2− + H2O NO2−
- 26. Заключение Любая ОВР представляет собой единство двух противоположных превращений – окисления и восстановления, в которых участвуют
- 28. Скачать презентацию





















 Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) Молярный объем
Молярный объем Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Презентация на тему Нанохимия
Презентация на тему Нанохимия  Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Урок № 4
Урок № 4 Фторопласты и их использование
Фторопласты и их использование Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Криогенный разрыв пласта
Криогенный разрыв пласта Астат. Свойства астата
Астат. Свойства астата Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Направление процесса. ОВР
Направление процесса. ОВР Гликолиз. Глюконеогенез. Пентозофосфатный путь
Гликолиз. Глюконеогенез. Пентозофосфатный путь Применение центрифугирования
Применение центрифугирования Основания. 8 класс
Основания. 8 класс Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Bool-doser team
Bool-doser team Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Титриметрический анализ
Титриметрический анализ Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Химический анализ
Химический анализ