Содержание
- 2. Алхимические символы серы Сера выражает одно из начал природы –горючесть. Сера – «отец металлов» - придаёт
- 3. Сера в природе кларк 0,03% Сфалерит ZnS Пирит FeS2 Самородок серы
- 4. Добыча самородной серы В районах вулканической деятельности серу добывают открытым способом: «носильщики серы» за один раз
- 5. Мировое производство серы 4 миллиона тонн/год
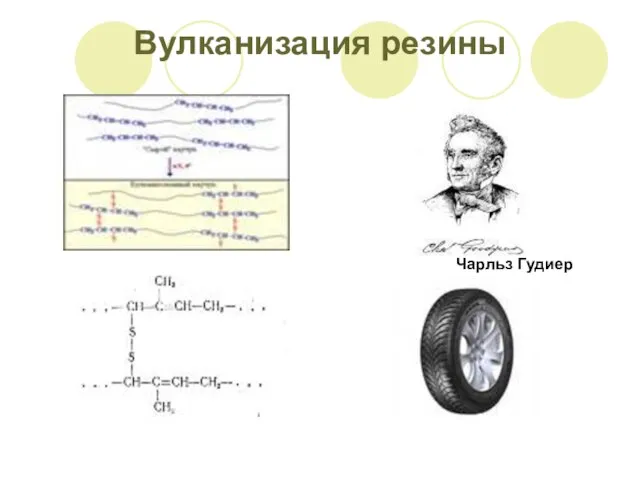
- 6. Вулканизация резины Чарльз Гудиер
- 7. Аллотропия серы Ромбическая сера: устойчивая модификация, жёлтый порошок, молекулы в форме замкнутого цикла из 8 атомов.
- 8. Окислительно-восстановительная активность серы Сера-окислитель с более активными восстановителями (металлами, водородом) S + 2e →S-2 Сера –
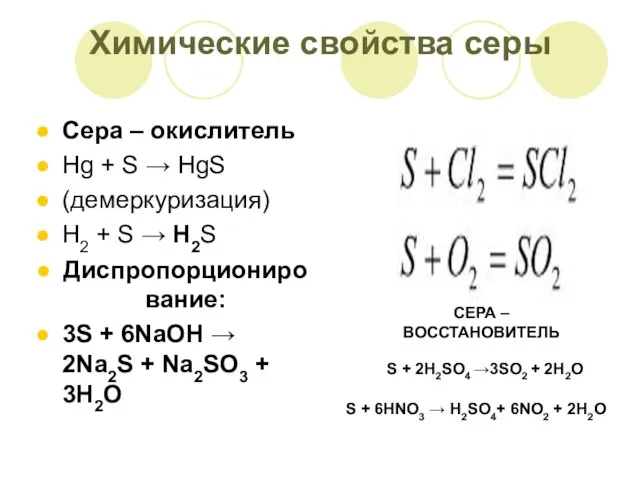
- 9. Химические свойства серы Сера – окислитель Hg + S → HgS (демеркуризация) H2 + S →
- 10. Недостаток серы у растений Листья светло-зелёные, позже – жёлтые, с красноватыми пятнами. Стебли тонкие, хрупкие, одеревеневшие.
- 11. Продукты, содержащие серу
- 13. Скачать презентацию








 Алюминий и алюминиевые сплавы
Алюминий и алюминиевые сплавы Металлы и их соединения
Металлы и их соединения Презентация на тему Микроэлементы: Хром, Йод, Фтор
Презентация на тему Микроэлементы: Хром, Йод, Фтор  Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Презентация на тему Каучук
Презентация на тему Каучук  Основания
Основания Ионная связь
Ионная связь Предельные углеводороды
Предельные углеводороды Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Расчетная работа. Тепловой эффект клинкерообразования
Расчетная работа. Тепловой эффект клинкерообразования Индолы. Cтроение индола
Индолы. Cтроение индола Ароматические гетероциклические соединения
Ароматические гетероциклические соединения Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Химия. (Задачи)
Химия. (Задачи) ВПР – это интересно
ВПР – это интересно Химическая связь
Химическая связь Общие сведения о питании и приготовлении пищи
Общие сведения о питании и приготовлении пищи Силумины. Виды силуминов
Силумины. Виды силуминов Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Химия. Подготовка к контрольной работе
Химия. Подготовка к контрольной работе Белки
Белки Строение атома. История открытия
Строение атома. История открытия Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Показатели обогащения
Показатели обогащения Презентация по Химии "Незнайка в стране химия"
Презентация по Химии "Незнайка в стране химия"  Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method
Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method